Cálculo de la constante de equilibrio del sistema. Equilibrio químico
Constante equilibrio químico
Mayoría reacciones químicas reversible, es decir fluyen simultáneamente en direcciones opuestas. En los casos en que las reacciones directas e inversas ocurren a la misma velocidad, se produce el equilibrio químico. Por ejemplo, en una reacción homogénea reversible: H 2 (g) + I 2 (g) ↔ 2HI (g), la relación entre las velocidades de reacciones directas e inversas según la ley de acción de masas depende de la relación de las concentraciones. de los reactivos, a saber: la velocidad de la reacción directa: υ 1 = k 1 [H 2 ]. Velocidad de reacción inversa: υ 2 = k 2 2.
Si H 2 y I 2 son sustancias de partida, entonces en el primer momento la velocidad de la reacción directa está determinada por sus concentraciones iniciales y la velocidad de la reacción inversa es cero. A medida que se consumen H 2 e I 2 y se forma HI, la velocidad de la reacción directa disminuye y la velocidad de la reacción inversa aumenta. Después de un tiempo, ambas velocidades se igualan y se establece el equilibrio químico en el sistema, es decir. el número de moléculas de HI producidas y consumidas por unidad de tiempo se vuelve el mismo.
Dado que en el equilibrio químico las velocidades de reacciones directas e inversas son iguales a V 1 = V 2, entonces k 1 = k 2 2.
Dado que k 1 y k 2 son constantes a una temperatura dada, su relación será constante. Denotándolo por K, obtenemos:

K se llama constante de equilibrio químico y la ecuación anterior se llama ley de acción de masas (Guldberg-Waale).
En el caso general, para una reacción de la forma aA+bB+…↔dD+eE+…, la constante de equilibrio es igual a ![]() . Para la interacción entre sustancias gaseosas, a menudo se utiliza la expresión en la que los reactivos están representados por presiones parciales de equilibrio p. Para la reacción mencionada
. Para la interacción entre sustancias gaseosas, a menudo se utiliza la expresión en la que los reactivos están representados por presiones parciales de equilibrio p. Para la reacción mencionada  .
.
El estado de equilibrio caracteriza el límite hasta el cual, en determinadas condiciones, la reacción avanza espontáneamente (∆G<0). Если в системе наступило химическое равновесие, то дальнейшее изменение изобарного потенциала происходить не будет, т.е. ∆G=0.
La relación entre las concentraciones de equilibrio no depende de qué sustancias se toman como sustancias iniciales (por ejemplo, H 2 y I 2 o HI), es decir El estado de equilibrio se puede abordar desde ambos lados.
La constante de equilibrio químico depende de la naturaleza de los reactivos y de la temperatura; La constante de equilibrio no depende de la presión (si es demasiado alta) ni de la concentración de los reactivos.
Influencia en la constante de equilibrio de los factores de temperatura, entalpía y entropía.. La constante de equilibrio está relacionada con el cambio en el potencial isobárico-isotérmico estándar de una reacción química ∆G o mediante la ecuación simple ∆G o =-RT ln K.
Muestra que grandes valores negativos de ∆G o (∆G o<<0) отвечают большие значения К, т.е. в равновесной смеси преобладают продукты взаимодействия. Если же ∆G o характеризуется большими положительными значениями (∆G o >>0), entonces en la mezcla de equilibrio predominan las sustancias de partida. Esta ecuación permite calcular K a partir del valor de ∆G o, y luego de las concentraciones de equilibrio (presiones parciales) de los reactivos. Si tenemos en cuenta que ∆G o =∆Н o -Т∆S o , luego de alguna transformación obtenemos ![]() . De esta ecuación queda claro que la constante de equilibrio es muy sensible a los cambios de temperatura. La influencia de la naturaleza de los reactivos sobre la constante de equilibrio determina su dependencia de los factores de entalpía y entropía.
. De esta ecuación queda claro que la constante de equilibrio es muy sensible a los cambios de temperatura. La influencia de la naturaleza de los reactivos sobre la constante de equilibrio determina su dependencia de los factores de entalpía y entropía.
Volvamos al proceso de producción de amoníaco, expresado por la ecuación:
N 2 (g) + 3H 2 (g) → 2NH 3 (g)
Al estar en un volumen cerrado, el nitrógeno y el hidrógeno se combinan y forman amoníaco. ¿Cuánto durará este proceso? Es lógico suponer que hasta que se acabe alguno de los reactivos. Sin embargo, en la vida real esto no es del todo cierto. El hecho es que algún tiempo después del inicio de la reacción, el amoníaco resultante comenzará a descomponerse en nitrógeno e hidrógeno, es decir, comenzará una reacción inversa:
2NH 3 (g) → N 2 (g) + 3H 2 (g)
De hecho, en un volumen cerrado tendrán lugar a la vez dos reacciones directamente opuestas entre sí. Por lo tanto, este proceso se escribe mediante la siguiente ecuación:
N2 (g) + 3H2 (g) ↔ 2NH3 (g)
Una doble flecha indica que la reacción se desarrolla en dos direcciones. La reacción de combinación de nitrógeno e hidrógeno se llama reacción directa. Reacción de descomposición del amoníaco - reacción.
Al comienzo del proceso, la velocidad de reacción directa es muy alta. Pero con el tiempo, las concentraciones de los reactivos disminuyen y la cantidad de amoníaco aumenta; como resultado, la velocidad de la reacción directa disminuye y la velocidad de la reacción inversa aumenta. Llega un momento en el que se comparan las velocidades de las reacciones directas e inversas: se produce un equilibrio químico o un equilibrio dinámico. En el equilibrio, ocurren reacciones directas e inversas, pero sus velocidades son las mismas, por lo que no se notan cambios.
Equilibrio constante
Diferentes reacciones proceden de diferentes maneras. En algunas reacciones, se forma una cantidad bastante grande de productos de reacción antes de que se produzca el equilibrio; en otros, mucho menos. Por tanto, podemos decir que una ecuación particular tiene su propia constante de equilibrio. Conociendo la constante de equilibrio de una reacción, es posible determinar las cantidades relativas de reactivos y productos de reacción en las que se produce el equilibrio químico.
Describa alguna reacción mediante la ecuación: aA + bB = cC + dD
- a, b, c, d - coeficientes de la ecuación de reacción;
- A, B, C, D: fórmulas químicas de sustancias.
Equilibrio constante:
[C] c [D] d K = ———————— [A] a [B] b
Los corchetes indican que la fórmula implica concentraciones molares de sustancias.
¿Qué dice la constante de equilibrio?
Para la síntesis de amoníaco a temperatura ambiente K = 3,5·10 8. Este es un número bastante grande, lo que indica que el equilibrio químico se producirá cuando la concentración de amoníaco sea mucho mayor que la de los materiales de partida restantes.
En la producción real de amoníaco, la tarea del tecnólogo es obtener el coeficiente de equilibrio más alto posible, es decir, que la reacción directa avance hasta su finalización. ¿Cómo se puede lograr esto?
El principio de Le Chatelier
El principio de Le Chatelier lee:
¿Cómo entender esto? Todo es muy sencillo. Hay tres formas de alterar el equilibrio:
- cambiar la concentración de la sustancia;
- cambiar la temperatura;
- cambiando la presión.
Cuando la reacción de síntesis de amoníaco está en equilibrio, se puede representar de la siguiente manera (la reacción es exotérmica):
N 2 (g) + 3H 2 (g) → 2NH 3 (g) + Calor
Cambio de concentración
Introduzcamos nitrógeno adicional en un sistema equilibrado. Esto alterará el equilibrio:

La reacción directa comenzará a avanzar más rápido porque la cantidad de nitrógeno ha aumentado y reacciona más. Después de algún tiempo, el equilibrio químico volverá a ocurrir, pero la concentración de nitrógeno será mayor que la concentración de hidrógeno:

Pero es posible "inclinar" el sistema hacia el lado izquierdo de otra manera: "aligerando" el lado derecho, por ejemplo, eliminando el amoníaco del sistema a medida que se forma. Por tanto, volverá a predominar la reacción directa de formación de amoníaco.
Cambiando la temperatura
El lado derecho de nuestra “escala” se puede cambiar cambiando la temperatura. Para que el lado izquierdo "pese más", es necesario "aligerar" el lado derecho - reducir la temperatura:

Cambiando la presión
Es posible alterar el equilibrio en un sistema utilizando presión sólo en reacciones con gases. Hay dos formas de aumentar la presión:
- reducir el volumen del sistema;
- introducción de gas inerte.
A medida que aumenta la presión, aumenta el número de colisiones moleculares. Al mismo tiempo, la concentración de gases en el sistema aumenta y las velocidades de reacciones directas e inversas cambian: se altera el equilibrio. Para restablecer el equilibrio, el sistema "intenta" reducir la presión.
Durante la síntesis de amoníaco, se forman dos moléculas de amoníaco a partir de 4 moléculas de nitrógeno e hidrógeno. Como resultado, la cantidad de moléculas de gas disminuye y la presión cae. Como consecuencia, para alcanzar el equilibrio después de aumentar la presión, aumenta la velocidad de la reacción directa.
Resumir. Según el principio de Le Chatelier, la producción de amoníaco puede incrementarse mediante:
- aumentar la concentración de reactivos;
- reducir la concentración de productos de reacción;
- reducir la temperatura de reacción;
- aumentando la presión a la que se produce la reacción.
La mayoría de las reacciones químicas son reversibles, es decir. fluyen simultáneamente en direcciones opuestas. En los casos en que las reacciones directas e inversas ocurren a la misma velocidad, se produce el equilibrio químico. Por ejemplo, en una reacción homogénea reversible: H 2 (g) + I 2 (g) ↔ 2HI (g), la relación entre las velocidades de reacciones directas e inversas según la ley de acción de masas depende de la relación de las concentraciones. de los reactivos, a saber: la velocidad de la reacción directa: υ 1 = k 1 [H 2 ]. Velocidad de reacción inversa: υ 2 = k 2 2.
Si H 2 y I 2 son sustancias de partida, entonces en el primer momento la velocidad de la reacción directa está determinada por sus concentraciones iniciales y la velocidad de la reacción inversa es cero. A medida que se consumen H 2 e I 2 y se forma HI, la velocidad de la reacción directa disminuye y la velocidad de la reacción inversa aumenta. Después de un tiempo, ambas velocidades se igualan y se establece el equilibrio químico en el sistema, es decir. el número de moléculas de HI producidas y consumidas por unidad de tiempo se vuelve el mismo.
Dado que en el equilibrio químico las velocidades de reacciones directas e inversas son iguales a V 1 = V 2, entonces k 1 = k 2 2.
Dado que k 1 y k 2 son constantes a una temperatura dada, su relación será constante. Denotándolo por K, obtenemos:

K se llama constante de equilibrio químico y la ecuación anterior se llama ley de acción de masas (Guldberg-Waale).
En el caso general, para una reacción de la forma aA+bB+…↔dD+eE+…, la constante de equilibrio es igual a ![]() . Para la interacción entre sustancias gaseosas, a menudo se utiliza la expresión en la que los reactivos están representados por presiones parciales de equilibrio p. Para la reacción mencionada
. Para la interacción entre sustancias gaseosas, a menudo se utiliza la expresión en la que los reactivos están representados por presiones parciales de equilibrio p. Para la reacción mencionada  .
.
El estado de equilibrio caracteriza el límite hasta el cual, en determinadas condiciones, la reacción avanza espontáneamente (∆G<0). Если в системе наступило химическое равновесие, то дальнейшее изменение изобарного потенциала происходить не будет, т.е. ∆G=0.
La relación entre las concentraciones de equilibrio no depende de qué sustancias se toman como sustancias iniciales (por ejemplo, H 2 y I 2 o HI), es decir El estado de equilibrio se puede abordar desde ambos lados.
La constante de equilibrio químico depende de la naturaleza de los reactivos y de la temperatura; La constante de equilibrio no depende de la presión (si es demasiado alta) ni de la concentración de los reactivos.
Influencia en la constante de equilibrio de los factores de temperatura, entalpía y entropía.. La constante de equilibrio está relacionada con el cambio en el potencial isobárico-isotérmico estándar de una reacción química ∆G o mediante la ecuación simple ∆G o =-RT ln K.
Muestra que grandes valores negativos de ∆G o (∆G o<<0) отвечают большие значения К, т.е. в равновесной смеси преобладают продукты взаимодействия. Если же ∆G o характеризуется большими положительными значениями (∆G o >>0), entonces en la mezcla de equilibrio predominan las sustancias de partida. Esta ecuación permite calcular K a partir del valor de ∆G o, y luego de las concentraciones de equilibrio (presiones parciales) de los reactivos. Si tenemos en cuenta que ∆G o =∆Н o -Т∆S o , luego de alguna transformación obtenemos ![]() . De esta ecuación queda claro que la constante de equilibrio es muy sensible a los cambios de temperatura. La influencia de la naturaleza de los reactivos sobre la constante de equilibrio determina su dependencia de los factores de entalpía y entropía.
. De esta ecuación queda claro que la constante de equilibrio es muy sensible a los cambios de temperatura. La influencia de la naturaleza de los reactivos sobre la constante de equilibrio determina su dependencia de los factores de entalpía y entropía.
El principio de Le Chatelier
El estado de equilibrio químico se mantiene en condiciones constantes dadas en cualquier momento. Cuando las condiciones cambian, se altera el estado de equilibrio, ya que en este caso las velocidades de los procesos opuestos cambian en diversos grados. Sin embargo, después de algún tiempo, el sistema vuelve a alcanzar un estado de equilibrio, pero esta vez correspondiente a las nuevas condiciones cambiadas.
El desplazamiento del equilibrio en función de los cambios en las condiciones generalmente está determinado por el principio de Le Chatelier (o el principio del equilibrio en movimiento): Si un sistema en equilibrio se ve influenciado desde el exterior cambiando cualquiera de las condiciones que determinan la posición de equilibrio, entonces se desplaza en la dirección del proceso, cuyo curso debilita el efecto producido.
Así, un aumento de temperatura provoca un desplazamiento del equilibrio en la dirección de los procesos cuyo curso va acompañado de la absorción de calor, y una disminución de temperatura actúa en la dirección opuesta. De manera similar, un aumento de presión desplaza el equilibrio en la dirección de un proceso acompañado de una disminución de volumen, y una disminución de presión actúa en la dirección opuesta. Por ejemplo, en el sistema de equilibrio 3H 2 +N 2 2H 3 N, ∆H o = -46,2 kJ, un aumento de temperatura mejora la descomposición de H 3 N en hidrógeno y nitrógeno, ya que este proceso es endotérmico. Un aumento de presión desplaza el equilibrio hacia la formación de H 3 N, porque el volumen disminuye.
Si se agrega una cierta cantidad de cualquiera de las sustancias que participan en la reacción a un sistema en estado de equilibrio (o, por el contrario, se elimina del sistema), entonces las velocidades de las reacciones directa e inversa cambian, pero se igualan gradualmente nuevamente. En otras palabras, el sistema vuelve a un estado de equilibrio químico. En este nuevo estado, las concentraciones de equilibrio de todas las sustancias presentes en el sistema diferirán de las concentraciones de equilibrio originales, pero la relación entre ellas seguirá siendo la misma. Por tanto, en un sistema en equilibrio, es imposible cambiar la concentración de una de las sustancias sin provocar un cambio en las concentraciones de todas las demás.
De acuerdo con el principio de Le Chatelier, la introducción de cantidades adicionales de un reactivo en un sistema de equilibrio provoca un cambio de equilibrio en la dirección en la que disminuye la concentración de esta sustancia y, en consecuencia, aumenta la concentración de los productos de su interacción.
El estudio del equilibrio químico es de gran importancia tanto para la investigación teórica como para la resolución de problemas prácticos. Al determinar la posición de equilibrio para diversas temperaturas y presiones, es posible seleccionar las condiciones más favorables para el proceso químico. Al realizar la elección final de las condiciones del proceso, también se tiene en cuenta su efecto sobre la velocidad del proceso.
Ejemplo 1. Cálculo de la constante de equilibrio de una reacción a partir de las concentraciones de equilibrio de los reactivos.
Calcule la constante de equilibrio de la reacción A + B 2C, si las concentraciones de equilibrio [A] = 0,3 mol∙l -1; [V]=1,1mol∙l-1; [C]=2,1mol∙l-1.
Solución. La expresión de la constante de equilibrio para esta reacción tiene la forma: . Sustituyamos aquí las concentraciones de equilibrio indicadas en el planteamiento del problema: =5,79.
Ejemplo 2. Cálculo de concentraciones de equilibrio de sustancias reactivas. La reacción transcurre según la ecuación A + 2B C.
Determine las concentraciones de equilibrio de las sustancias que reaccionan si las concentraciones iniciales de las sustancias A y B son respectivamente 0,5 y 0,7 mol∙l -1, y la constante de equilibrio de la reacción K p = 50.
Solución. Por cada mol de sustancias A y B, se forman 2 moles de sustancia C. Si la disminución en la concentración de las sustancias A y B se denota por X mol, entonces el aumento en la concentración de la sustancia será igual a 2X mol. Las concentraciones de equilibrio de los reactivos serán:
C A = (aproximadamente 5-x)mol∙l -1; C B = (0,7-x) mol∙l -1; C C =2x mol∙l -1
x1 = 0,86; x2=0,44
Según las condiciones del problema, el valor x 2 es válido. Por tanto, las concentraciones de equilibrio de los reactivos son:
C A =0,5-0,44=0,06mol∙l-1; C B =0,7-0,44=0,26mol∙l-1; C C =0,44∙2=0,88mol∙l -1.
Ejemplo 3. Determinación del cambio en la energía de Gibbs ∆G o de una reacción por el valor de la constante de equilibrio K r. Calcule la energía de Gibbs y determine la posibilidad de la reacción CO + Cl 2 = COCl 2 a 700 K si la constante de equilibrio es igual a Kp = 1,0685∙10 -4. La presión parcial de todas las sustancias que reaccionan es la misma e igual a 101325 Pa.
Solución.∆G 700 =2.303∙RT ![]() .
.
Para este proceso:
Desde ∆Go<0, то реакция СО+Cl 2 COCl 2 при 700К возможна.
Ejemplo 4. Cambio en el equilibrio químico. ¿En qué dirección se desplazará el equilibrio en el sistema N 2 +3H 2 2NH 3 -22kcal?
a) con una concentración creciente de N 2;
b) con una concentración creciente de H 2;
c) al aumentar la temperatura;
d) cuando la presión disminuye?
Solución. Según la regla de Le Chatelier, un aumento en la concentración de sustancias en el lado izquierdo de la ecuación de reacción debería provocar un proceso que tiende a debilitar el efecto y conducir a una disminución de las concentraciones, es decir el equilibrio se desplazará hacia la derecha (casos a y b).
La reacción de síntesis de amoníaco es exotérmica. Un aumento de temperatura provoca un desplazamiento del equilibrio hacia la izquierda, hacia una reacción endotérmica, debilitando el efecto (caso c).
Una disminución de la presión (caso d) favorecerá una reacción que conducirá a un aumento del volumen del sistema, es decir hacia la formación de N 2 y H 2.
Ejemplo 5.¿Cuántas veces cambiará la velocidad de la reacción directa e inversa en el sistema 2SO 2 (g) + O 2 (g) 2SO 3 (r) si el volumen de la mezcla de gases disminuye tres veces? ¿En qué dirección se desplazará el equilibrio del sistema?
Solución. Denotemos las concentraciones de reactivos: = A, =b,=Con. Según la ley de acción de masas, las velocidades de reacciones directas e inversas antes del cambio de volumen son iguales.
v pr = Ka 2 b, v arr = K 1 s 2
Después de reducir tres veces el volumen de un sistema homogéneo, la concentración de cada uno de los reactivos aumentará tres veces: = 3a,[O2] = 3b; = 3 chelines. En nuevas concentraciones, la velocidad v" np de las reacciones directa e inversa:
v" np = K(3a) 2 (3b) = 27 Ka 2 b; v o 6 p = K 1 (3c) 2 = 9K 1 c 2.
![]() ;
; ![]()
En consecuencia, la velocidad de la reacción directa aumentó 27 veces y la reacción inversa sólo nueve veces. El equilibrio del sistema se desplazó hacia la formación de SO 3.
Ejemplo 6. Calcule cuántas veces aumentará la velocidad de una reacción que ocurre en la fase gaseosa cuando la temperatura aumenta de 30 a 70 0 C, si el coeficiente de temperatura de la reacción es 2.
Solución. La dependencia de la velocidad de una reacción química de la temperatura está determinada por la regla empírica de Van't Hoff según la fórmula
En consecuencia, la velocidad de reacción a 70°C es 16 veces mayor que la velocidad de reacción a 30°C.
Ejemplo 7. Constante de equilibrio de un sistema homogéneo.
CO(g) + H 2 O(g) CO 2 (g) + H 2 (g) a 850°C es igual a 1. Calcular las concentraciones de todas las sustancias en equilibrio si las concentraciones iniciales son: [CO] ISH = 3 mol/l, [H2O]RI = 2 mol/l.
Solución. En el equilibrio, las velocidades de las reacciones directa e inversa son iguales, y la relación de las constantes de estas velocidades es constante y se llama constante de equilibrio del sistema dado:
V np = k 1[CO][H2O]; V o b p = A 2 [CO2][H2];
![]()
En el planteamiento del problema se dan las concentraciones iniciales, mientras que en la expresión k r Incluye sólo las concentraciones de equilibrio de todas las sustancias del sistema. Supongamos que en el momento de equilibrio la concentración [CO 2 ] P = X prostituta. Según la ecuación del sistema, el número de moles de hidrógeno formados también será X prostituta. Para la misma cantidad de moles (X mol/l) CO y H 2 O se consumen para formar X moles de CO 2 y H 2. Por lo tanto, las concentraciones de equilibrio de las cuatro sustancias (mol/l):
[CO 2 ] P = [H 2 ] P = X;[CO] P = (3 – x); P =(2x).
Conociendo la constante de equilibrio, encontramos el valor. X, y luego las concentraciones iniciales de todas las sustancias:
![]() ; x 2 =6-2x-3x + x 2; 5x = 6, l = 1,2 mol/l.
; x 2 =6-2x-3x + x 2; 5x = 6, l = 1,2 mol/l.
El equilibrio químico es un estado de reacción química reversible.
aA+ b B= C C+ d D,
en el que no hay cambios en las concentraciones de los reactivos en la mezcla de reacción a lo largo del tiempo. El estado de equilibrio químico se caracteriza. constante de equilibrio químico:
Dónde C yo– concentración de componentes en equilibrio mezcla perfecta.
La constante de equilibrio también se puede expresar en términos de fracciones molares de equilibrio. X yo componentes:
Para reacciones que ocurren en fase gaseosa, es conveniente expresar la constante de equilibrio en términos de presiones parciales de equilibrio. Pi componentes:
Para gases ideales Pi = C i RT Y Pi = X y P, Dónde PAG es la presión total, por lo tanto kp, kc Y kx están relacionados por la siguiente relación:
K P = K C (RT) c+d–a–b = K X P c+d–a–b. (9.4)
La constante de equilibrio está relacionada con rG o reacción química:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
Cambiar rG o rF en una reacción química a presiones parciales dadas (no necesariamente de equilibrio) Pi o concentraciones C yo Los componentes se pueden calcular usando la ecuación. isotermas de reacciones químicas (isotermas de van't hoff):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
De acuerdo a El principio de Le Chatelier, si se ejerce una influencia externa sobre un sistema que está en equilibrio, entonces el equilibrio se desplazará para reducir el efecto de la influencia externa. Por tanto, un aumento de presión desplaza el equilibrio hacia una disminución del número de moléculas de gas. Agregar cualquier componente de reacción a una mezcla en equilibrio desplaza el equilibrio hacia una disminución en la cantidad de este componente. Un aumento (o disminución) de la temperatura desplaza el equilibrio hacia una reacción que ocurre con la absorción (liberación) de calor.
La dependencia cuantitativa de la constante de equilibrio de la temperatura se describe mediante la ecuación isobaras de reacción química (isobaras de van't hoff)
![]() (9.9)
(9.9)
Y isocoros de una reacción química (isocoras de van't hoff)
![]() . (9.10)
. (9.10)
Integrando la ecuación (9.9) bajo el supuesto de que Rh La reacción no depende de la temperatura (lo cual es cierto en rangos de temperatura estrechos), da:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
Dónde C - constante de integración. Así, la dependencia en k P de 1 /T debe ser lineal y la pendiente de la línea recta es – Rh/R.
Integración dentro k 1 , k 2 , y t 1, t 2 da:
 (9.13)
(9.13)
 (9.14)
(9.14)
Usando esta ecuación, conociendo las constantes de equilibrio a dos temperaturas diferentes, podemos calcular Rh reacciones. En consecuencia, sabiendo Rh reacción y la constante de equilibrio a una temperatura, puedes calcular la constante de equilibrio a otra temperatura.
EJEMPLOS
CO(g) + 2H 2 (g) = CH 3 OH(g)
a 500 k. f ir o para CO(g) y CH 3 OH(g) a 500 K son iguales a –155,41 kJ. mol –1 y –134,20 kJ. moles –1 respectivamente.
Solución. Ir reacciones:
r ir o= f ir o(CH3OH) – f ir o(CO) = –134,20 – (–155,41) = 21,21 kJ. moles –1 .
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
Ejemplo 9-2. Constante de equilibrio de reacción
igual a k P = 1,64 10 –4 a 400 o C. ¿Qué presión total se debe aplicar a una mezcla equimolar de N 2 y H 2 para que el 10% de N 2 se convierta en NH 3? Los gases se consideran ideales.
Solución. Deje reaccionar un mol de N 2. Entonces
| norte 2 (g) | + | 3H2 (g) | = | 2NH3 (g) | |
| Cantidad original | 1 | 1 | |||
| Cantidad equilibrada | 1– | 1–3 | 2 (total: 2-2) | ||
| Fracción molar de equilibrio: |
Por eso, k X = 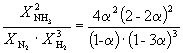 Y K P = K X . PAG –2
=
Y K P = K X . PAG –2
=  .
.
Sustituyendo = 0,1 en la fórmula resultante, tenemos
1.64 10 –4 =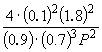 , dónde PAG= 51,2 atmósferas.
, dónde PAG= 51,2 atmósferas.
Ejemplo 9-3. Constante de equilibrio de reacción
CO(g) + 2H 2 (g) = CH 3 OH(g)
a 500 K es igual a k P = 6,09 · 10 –3 . Una mezcla de reacción que consta de 1 mol de CO, 2 moles de H2 y 1 mol de gas inerte (N2) se calienta a 500 K y una presión total de 100 atm. Calcule la composición de la mezcla de equilibrio.
Solución. Dejar reaccionar un mol de CO. Entonces
| Diente) | + | 2H2 (g) | = | CH3OH(g) | |
| Cantidad original: | 1 | 2 | 0 | ||
| Cantidad equilibrada: | 1– | 2–2 | |||
| Total en mezcla en equilibrio: | 3–2 moles de componentes + 1 mol N 2 = 4–2 moles | ||||
| Fracción molar de equilibrio | |||||
Por eso, k X =  Y K P = K X . P–2 =
Y K P = K X . P–2 = ![]() .
.
Por tanto, 6,09 10 –3 = ![]() .
.
Resolviendo esta ecuación, obtenemos = 0,732. En consecuencia, las fracciones molares de sustancias en la mezcla de equilibrio son iguales a: = 0,288, = 0,106, = 0,212 y = 0,394.
Ejemplo 9-4. Para la reacción
N2 (g) + 3H2 (g) = 2NH3 (g)
a 298K k P = 6,0 · 10 · 5 , a f h o(NH3) = –46,1 kJ. moles –1 . Calcule el valor de la constante de equilibrio a 500 K.
Solución. La entalpía molar estándar de la reacción es
r H o= 2f h o(NH3) = –92,2 kJ. moles –1 .
Según la ecuación (9.14), 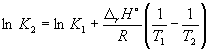 =
=
Ln (6,0 10 5) + ![]() = –1,73, de donde k 2 =
0.18.
= –1,73, de donde k 2 =
0.18.
Tenga en cuenta que la constante de equilibrio de una reacción exotérmica disminuye al aumentar la temperatura, lo que corresponde al principio de Le Chatelier.
TAREAS
- A 1273 K y una presión total de 30 atm en una mezcla en equilibrio
- A 2000 o C y una presión total de 1 atm, el 2% del agua se disocia en hidrógeno y oxígeno. Calcular la constante de equilibrio de la reacción.
- Constante de equilibrio de reacción
- Constante de equilibrio de reacción
- Un recipiente de 3 litros que contenía 1,79 10 –2 moles de I 2 se calentó a 973 K. La presión en el recipiente en equilibrio resultó ser de 0,49 atm. Suponiendo que los gases son ideales, calcule la constante de equilibrio a 973 K para la reacción.
- Para la reacción
- Para la reacción
- Un recipiente de 1 litro que contenía 0,341 mol de PCl 5 y 0,233 mol de N 2 se calentó a 250 o C. La presión total en el recipiente en equilibrio resultó ser 29,33 atm. Suponiendo que todos los gases son ideales, calcule la constante de equilibrio a 250 o C para la reacción que ocurre en el recipiente.
- Constante de equilibrio de reacción
- A 25ºC f ir o(NH3) = –16,5 kJ. moles –1 . Calcular rG reacciones de formación de NH 3 a presiones parciales de N 2, H 2 y NH 3 iguales a 3 atm, 1 atm y 4 atm, respectivamente. ¿En qué dirección procederá espontáneamente la reacción en estas condiciones?
- Reacción exotérmica
- La constante de equilibrio de la reacción en fase gaseosa de isomerización de borneol (C 10 H 17 OH) a isoborneol es 0,106 a 503 K. Se colocó una mezcla de 7,5 g de borneol y 14,0 g de isoborneol en un recipiente de 5 litros y se mantuvo a 503 K hasta alcanzar el equilibrio. Calcule las fracciones molares y las masas de borneol e isoborneol en la mezcla en equilibrio.
- Equilibrio en reacción
- Calcule la presión total que se debe aplicar a una mezcla de 3 partes de H 2 y 1 parte de N 2 para obtener una mezcla en equilibrio que contenga 10% de NH 3 en volumen a 400 o C. Constante de equilibrio de la reacción
- A 250 o C y una presión total de 1 atm, el PCl 5 se disocia en un 80% mediante la reacción
- A 2000 o C para reacción.
- Calcule la entalpía estándar de la reacción para la cual la constante de equilibrio es
a) aumenta 2 veces, b) disminuye 2 veces cuando la temperatura cambia de 298 K a 308 K. - La dependencia de la constante de equilibrio de la reacción 2C 3 H 6 (g) = C 2 H 4 (g) + C 4 H 8 (g) de la temperatura entre 300 K y 600 K se describe mediante la ecuación
CO 2 (g) + C(tv) = 2CO(g)
contiene 17% (en volumen) de CO 2 . ¿Qué porcentaje de CO 2 estará contenido en el gas a una presión total de 20 atm? ¿A qué presión el gas contendrá 25% de CO2?
H 2 O (g) = H 2 (g) + 1/2O 2 (g) en estas condiciones.
CO(g) + H 2 O(g) = CO 2 (g) + H 2 (g)
a 500 o C es igual kp= 5,5. A esta temperatura se calentó una mezcla compuesta por 1 mol de CO y 5 moles de H2O. Calcule la fracción molar de H2O en la mezcla en equilibrio.
N 2 O 4 (g) = 2NO 2 (g)
a 25 o C es igual kp= 0,143. Calcule la presión que se establecerá en un recipiente de 1 litro de volumen, en el que se colocó 1 g de N 2 O 4 a esta temperatura.
Yo 2 (g) = 2I (g).
a 250 ºC rG o = –2508 J mol –1. ¿A qué presión total el grado de conversión de PCl 5 en PCl 3 y Cl 2 a 250 o C será del 30%?
2HI(g) = H 2 (g) + I 2 (g)
equilibrio constante k P = 1,83 10 –2 a 698,6 K. ¿Cuántos gramos de HI se forman cuando se calientan 10 g de I 2 y 0,2 g de H 2 a esta temperatura en un recipiente de tres litros? ¿Cuáles son las presiones parciales de H 2, I 2 y HI?
PCl5 (g) = PCl3 (g) + Cl2 (g)
CO(g) + 2H 2 (g) = CH 3 OH(g)
a 500 K es igual a k P = 6,09 · 10 –3 . Calcule la presión total requerida para producir metanol con un rendimiento del 90% si se toman CO y H2 en una proporción de 1:2.
CO(g) + 2H 2 (g) = CH 3 OH(g)
está en equilibrio a 500 K y 10 bar. Si los gases son ideales, ¿cómo afectarán los siguientes factores al rendimiento de metanol: a) aumentar t; segundo) promoción PAG; c) añadir gas inerte a V= constante; d) añadir gas inerte a PAG= constante; e) agregar H 2 en PAG= constante?
2NOCl(g) = 2NO(g) + Cl2 (g)
fijado a 227 o C y una presión total de 1,0 bar cuando la presión parcial de NOCl es 0,64 bar (inicialmente solo estaba presente NOCl). Calcular r ir o para la reacción. ¿A qué presión total la presión parcial del Cl 2 será igual a 0,10 bar?
N2 (g) + 3H2 (g) = 2NH3 (g)
a 400 o C es igual k = 1.60 10 –4 .
PCl5 (g) = PCl3 (g) + Cl2 (g).
¿Cuál será el grado de disociación del PCl 5 si se agrega N 2 al sistema de modo que la presión parcial de nitrógeno sea 0,9 atm? La presión total se mantiene en 1 atm.
N 2 (g) + O 2 (g) = 2NO (g)
K p = 2,5 10 –3 . Una mezcla en equilibrio de N 2, O 2, NO y gas inerte a una presión total de 1 bar contiene 80% (en volumen) de N 2 y 16% de O 2. ¿Qué porcentaje en volumen es NO? ¿Cuál es la presión parcial de un gas inerte?
en k = –1.04 –1088 /t +1.51 10 5 /t 2 .
Estado químico equilibrio- este es un estado en el que el potencial químico de los productos y las sustancias iniciales son iguales entre sí, teniendo en cuenta la estequiometría del proceso.
Podemos hablar de equilibrio químico si se cumplen dos condiciones:
Las velocidades de reacciones directas e inversas son iguales.
El equilibrio existe si, cuando se aplica una influencia externa y luego cuando se elimina, el sistema vuelve a su estado original.
11. Ley de acción de masas.
A temperatura constante, la velocidad de una reacción química es directamente proporcional al producto de las concentraciones de las sustancias que reaccionan, tomadas en potencias iguales a los coeficientes estequiométricos en la ecuación de reacción.
Por ejemplo, para la reacción de síntesis de amoníaco:
N2 + 3H2 = 2NH3
la ley de acción de masas tiene la forma:
K s = 2 / 3
12. Constante de equilibrio en un sistema homogéneo. Formas de expresar la constante de equilibrio.
equilibrio constante es un valor constante igual a la relación de los productos de las concentraciones de equilibrio de los participantes de la reacción final e inicial, tomado en potencias correspondientes a los coeficientes estequiométricos
Homogéneo Las reacciones que ocurren en una fase se denominan: en una mezcla de gases, en un líquido o, a veces, en una solución sólida.
Formas de expresar la constante de equilibrio
Si las concentraciones de las sustancias involucradas en la reacción se expresan en unidades molares de molaridad, es decir en mol/l, normalmente se indica como Kc
Para una reacción de gas homogénea, es más conveniente expresar la constante de equilibrio en términos de las presiones parciales de las sustancias:

A veces es conveniente expresar la constante de equilibrio no en términos de presiones y concentraciones parciales, sino en términos de cantidades de sustancias:  o mediante las correspondientes fracciones molares:
o mediante las correspondientes fracciones molares: 
En el caso general, las constantes de equilibrio Kc, Kp, Kn y KN son diferentes.
13. Principio de Le Chatelier-Brown .
Si se ejerce una influencia externa sobre un sistema que está en equilibrio, entonces el equilibrio se desplaza en la dirección que debilita la influencia externa.
14. Ecuación isobárica de Van't Hoff.
Esta expresión nos permite evaluar cualitativamente la influencia de T sobre el equilibrio y la constante de equilibrio.
15.Fase.
La fase se llama - una parte homogénea de un sistema heterogéneo que tiene una interfaz real, dentro de la cual todas las propiedades pueden cambiar continuamente y al atravesarla abruptamente.
16.Constituyentes y componentes.
El componente se llama– el número mínimo de componentes suficiente para describir el estado de los sistemas.
Sustancias constituyentesson llamados - Sustancias que forman parte de un sistema que pueden aislarse utilizando métodos farmacológicos convencionales y que pueden existir fuera del sistema tanto tiempo como se desee.
17. Regla de la fase de Gibbs .
El número de grados de libertad de un sistema termodinámico en equilibrio, en el que influyen únicamente la temperatura y la presión entre factores externos, es igual al número de componentes independientes. S=K-F+norte(número de parámetros externos)
La regla de las fases muestra que el número de grados de libertad aumenta con el número de componentes y disminuye con el número de fases del sistema.
18. Condiciones de equilibrio de fases en el sistema.
En un sistema heterogéneo, existe equilibrio de fases si existen los siguientes tipos de equilibrios entre las fases:
Térmico (igualdad de temperatura)
Mecánico (igualdad de presiones)
Químico para cada componente
19.Ecuación de Clausio-Clausio
Dónde, - Δ V- cambio en el volumen de una sustancia durante su transición de la primera fase a la segunda, t – temperatura de transición, Δ h– cambio de entropía y entalpía de una sustancia durante la transición de 1 mol de una sustancia de una fase a otra
Le permite estimar cómo cambia la temperatura o la presión durante una transición de fase cuando cambian 2 parámetros.
20. diagrama del estado del agua
La relación entre cantidades que caracterizan el estado del sistema y las transformaciones de fase en el sistema: transición de sólido a líquido, de líquido a gaseoso.
21. Soluciones verdaderas. Formas de expresar la concentración de una solución. Cálculo de la fracción molar y de masa de una sustancia y la concentración molar de una sustancia en solución.

verdadera solución- se trata de un tipo de solución en la que el tamaño de las partículas del soluto es extremadamente pequeño y comparable al tamaño de las partículas del disolvente.
Hay soluciones gaseoso(mezclas de gases), líquido Y duro. La solución gaseosa es aire. El agua de mar es una mezcla de sales en agua, una solución líquida. Soluciones sólidas – aleaciones metálicas. Las soluciones constan de un disolvente y un soluto.
se llama solucion un sistema homogéneo sólido o líquido que consta de dos o más partes constituyentes.
Se considera un solvente.– una sustancia que determina el estado de agregación de una solución o una sustancia de mayor volumen o masa.
Métodos de expresión de la concentración de soluciones.
Concentración de solución es la masa o cantidad de un soluto en una cantidad, masa o volumen específico de una solución o solvente.
1) Fracción de masa ( Wisconsin ) es la masa de soluto contenida en 100 gramos de solución.
2) Fracción molar (mol) – X i – número de moles de componente contenidos en 1 mol de solución.
3) Concentración molar (molalidad) mi – número de moles de soluto contenidos en 1 kg de disolvente [mol/kg].
4) Concentración molar CON i – el número de moles de sustancia disuelta contenidos en 1 litro o 1 dm3 de solución [mol/l].
