Большинство химических реакций обратимы, т.е. протекают одновременно в противоположных направлениях. В тех случаях, когда прямая и обратная реакции идут с одинаковой скоростью, наступает химическое равновесие. Например, в обратимой гомогенной реакции: H 2 (г) + I 2 (г) ↔ 2HI(г) соотношение скоростей прямой и обратной реакций согласно закону действующих масс зависит от соотношения концентраций реагирующих веществ, а именно: скорость прямой реакции: υ 1 = k 1 [Н 2 ]. Скорость обратной реакции: υ 2 = k 2 2 .
Если H 2 и I 2 – исходные вещества, то в первый момент скорость прямой реакции определяется их начальными концентрациями, а скорость обратной реакции равна нулю. По мере израсходования H 2 и I 2 и образования HI скорость прямой реакции уменьшается, а скорость обратной реакции возрастает. Спустя некоторое время обе скорости уравниваются, и в системе устанавливается химическое равновесие, т.е. число образующихся и расходуемых молекул HI в единицу времени становится одинаковым.
Так как при химическом равновесии скорости прямой и обратной реакций равны V 1 = V 2 , то k 1 = k 2 2 .
Поскольку k 1 и k 2 при данной температуре постоянны, то их отношение будет постоянным. Обозначая его через K, получим:

К – называется константой химического равновесия, а приведенное уравнение – законом действующих масс (Гульдберга — Ваале).
В общем случае для реакции вида аА+bB+…↔dD+eE+… константа равновесия равна ![]() . Для взаимодействия между газообразными веществами часто пользуются выражением , в котором реагенты представлены равновесными парциальными давлениями p. Для упомянутой реакции
. Для взаимодействия между газообразными веществами часто пользуются выражением , в котором реагенты представлены равновесными парциальными давлениями p. Для упомянутой реакции  .
.
Состояние равновесия характеризует тот предел, до которого в данных условиях реакция протекает самопроизвольно (∆G
Соотношение между равновесными концентрациями не зависит от того, какие вещества берутся в качестве исходных (например, H 2 и I 2 или HI), т.е. к состоянию равновесия можно подойти с обеих сторон.
Константа химического равновесия зависит от природы реагентов и от температуры; от давления (если оно слишком высокое) и от концентрации реагентов константа равновесия не зависит.
Влияние на константу равновесия температуры, энтальпийного и энтропийного факторов. Константа равновесия связана с изменением стандартного изобарно-изотермического потенциала химической реакции ∆G o простым уравнением ∆G o =-RT ln K.
Из него видно, что большим отрицательным значениям ∆G o (∆G o >0), то в равновесной смеси преобладают исходные вещества. Указанное уравнение позволяет по величине ∆G o вычислить К, а затем и равновесные концентрации (парциальные давления) реагентов. Если учесть, что ∆G o =∆Н o -Т∆S o , то после некоторого преобразования получим ![]() . Из этого уравнения видно, что константа равновесия очень чувствительна к изменению температуры. Влияние на константу равновесия природы реагентов определяет ее зависимость от энтальпийного и энтропийного факторов.
. Из этого уравнения видно, что константа равновесия очень чувствительна к изменению температуры. Влияние на константу равновесия природы реагентов определяет ее зависимость от энтальпийного и энтропийного факторов.
Вернемся к процессу производства аммиака, выражающемуся уравнением:
N 2 (г) + 3H 2 (г) → 2NH 3 (г)
Находясь в закрытом объеме, азот и водород соединяются и образуют аммиак. До каких пор будет протекать этот процесс? Логично предположить, что до тех пор, пока какой-либо из реагентов не закончится. Однако, в реальной жизни это не совсем так. Дело в том, что через некоторое время после того, как началась реакция, образовавшийся аммиак станет разлагаться на азот и водород, т.е., начнется обратная реакция:
2NH 3 (г) → N 2 (г) + 3H 2 (г)
Фактически в закрытом объеме будут протекать сразу две, прямо противоположные друг другу, реакции. Поэтому, данный процесс записывается таким уравнением:
N 2 (г) + 3H 2 (г) ↔ 2NH 3 (г)
Двойная стрелка указывает на то, что реакция идет в двух направлениях. Реакция соединения азота и водорода называется прямой реакцией. Реакция разложения аммиака — обратной реакцией.
В самом начале процесса скорость прямой реакции очень велика. Но с течением времени концентрации реагентов уменьшаются, а количество аммиака возрастает — как следствие скорость прямой реакции уменьшается, а скорость обратной — возрастает. Наступает время, когда скорости прямой и обратной реакций сравниваются — наступает химическое равновесие или динамическое равновесие. При равновесии протекает как прямая, так и обратная реакции, но их скорости одинаковы, поэтому изменений не заметно.
Константа равновесия
Разные реакции протекают по-разному. В одних реакциях до момента наступления равновесия образуется довольно большое количество продуктов реакции; в других — гораздо меньше. Т.о., можно сказать, что конкретное уравнение имеет свою константу равновесия. Зная константу равновесия реакции, можно определить относительное количество реагентов и продуктов реакции, при котором наступает химическое равновесие.
Пусть некоторая реакция описывается уравнением: aA + bB = cC + dD
- a, b, c, d — коэффициенты уравнения реакции;
- A, B, C, D — химические формулы веществ.
Константа равновесия:
[C] c [D] dK = ———————— [A] a [B] b
Квадратные скобки показывают, что в формуле участвуют молярные концентрации веществ.
О чем говорит константа равновесия?
Для синтеза аммиака при комнатной температуре К=3,5·10 8 . Это довольно большое число, свидетельствующее о том, что химическое равновесие наступит когда концентрация аммиака будет намного больше оставшихся исходных веществ.
При реальном производстве аммиака задача технолога состоит в том, чтобы получить как можно бОльший коэффициент равновесия, т.е., чтобы прямая реакция прошла до конца. Каким образом этого можно добиться?
Принцип Ле Шателье
Принцип Ле Шателье гласит:
Как это понять? Все очень просто. Нарушить равновесие можно тремя способами:
- изменив концентрацию вещества;
- изменив температуру;
- изменив давление.
Когда реакция синтеза аммиака находится в равновесии, то это можно изобразить так (реакция экзотермическая):
N 2 (г) + 3H 2 (г) → 2NH 3 (г) + Теплота
Меняем концентрацию
Введем дополнительное количество азота в сбалансированную систему. При этом баланс нарушится:

Прямая реакция начнет протекать быстрее, поскольку количество азота увеличилось и он вступает в реакцию в большем количестве. Через некоторое время снова наступит химическое равновесие, но при этом концентрация азота будет больше, чем концентрация водрода:

Но, осуществить «перекос» системы в левую часть можно и другим способом — «облегчив» правую часть, например, отводить аммиак из системы по мере его образования. Т.о., снова будет преобладать прямая реакция образования аммиака.
Меняем температуру
Правую сторону наших «весов» можно изменять путем изменения температуры. Для того, чтобы левая часть «перевесила», необходимо «облегчить» правую часть — уменьшить температуру:

Меняем давление
Нарушить равновесие в системе при помощи давления можно только в реакциях с газами. Увеличить давление можно двумя способами:
- уменьшением объема системы;
- введением инертного газа.
При увеличении давления количество столкновений молекул возрастает. При этом повышается концентрация газов в системе и изменяются скорости прямой и обратной реакций — равновесие нарушается. Чтобы восстановить равновесие система «пытается» уменьшить давление.
Во время синтеза аммиака из 4-х молекул азота и водорода образуется две молекулы аммиака. В итоге количество молекул газов уменьшается — давление падает. Как следствие, чтобы придти к равновесию после увеличения давления, скорость прямой реакции возрастает.
Подведем итог. Согласно принципу Ле Шателье увеличить производство аммиака можно:
- увеличивая концентрацию реагентов;
- уменьшая концентрацию продуктов реакции;
- уменьшая температуру реакции;
- увеличивая давление при котором происходит реакция.
Большинство химических реакций обратимы, т.е. протекают одновременно в противоположных направлениях. В тех случаях, когда прямая и обратная реакции идут с одинаковой скоростью, наступает химическое равновесие. Например, в обратимой гомогенной реакции: H 2 (г) + I 2 (г) ↔ 2HI(г) соотношение скоростей прямой и обратной реакций согласно закону действующих масс зависит от соотношения концентраций реагирующих веществ, а именно: скорость прямой реакции: υ 1 = k 1 [Н 2 ]. Скорость обратной реакции: υ 2 = k 2 2 .
Если H 2 и I 2 – исходные вещества, то в первый момент скорость прямой реакции определяется их начальными концентрациями, а скорость обратной реакции равна нулю. По мере израсходования H 2 и I 2 и образования HI скорость прямой реакции уменьшается, а скорость обратной реакции возрастает. Спустя некоторое время обе скорости уравниваются, и в системе устанавливается химическое равновесие, т.е. число образующихся и расходуемых молекул HI в единицу времени становится одинаковым.
Так как при химическом равновесии скорости прямой и обратной реакций равны V 1 = V 2 , то k 1 = k 2 2 .
Поскольку k 1 и k 2 при данной температуре постоянны, то их отношение будет постоянным. Обозначая его через K, получим:

К – называется константой химического равновесия, а приведенное уравнение – законом действующих масс (Гульдберга — Ваале).
В общем случае для реакции вида аА+bB+…↔dD+eE+… константа равновесия равна ![]() . Для взаимодействия между газообразными веществами часто пользуются выражением , в котором реагенты представлены равновесными парциальными давлениями p. Для упомянутой реакции
. Для взаимодействия между газообразными веществами часто пользуются выражением , в котором реагенты представлены равновесными парциальными давлениями p. Для упомянутой реакции  .
.
Состояние равновесия характеризует тот предел, до которого в данных условиях реакция протекает самопроизвольно (∆G
Соотношение между равновесными концентрациями не зависит от того, какие вещества берутся в качестве исходных (например, H 2 и I 2 или HI), т.е. к состоянию равновесия можно подойти с обеих сторон.
Константа химического равновесия зависит от природы реагентов и от температуры; от давления (если оно слишком высокое) и от концентрации реагентов константа равновесия не зависит.
Влияние на константу равновесия температуры, энтальпийного и энтропийного факторов. Константа равновесия связана с изменением стандартного изобарно-изотермического потенциала химической реакции ∆G o простым уравнением ∆G o =-RT ln K.
Из него видно, что большим отрицательным значениям ∆G o (∆G o >0), то в равновесной смеси преобладают исходные вещества. Указанное уравнение позволяет по величине ∆G o вычислить К, а затем и равновесные концентрации (парциальные давления) реагентов. Если учесть, что ∆G o =∆Н o -Т∆S o , то после некоторого преобразования получим ![]() . Из этого уравнения видно, что константа равновесия очень чувствительна к изменению температуры. Влияние на константу равновесия природы реагентов определяет ее зависимость от энтальпийного и энтропийного факторов.
. Из этого уравнения видно, что константа равновесия очень чувствительна к изменению температуры. Влияние на константу равновесия природы реагентов определяет ее зависимость от энтальпийного и энтропийного факторов.
Принцип Ле Шателье
Состояние химического равновесия сохраняется при данных неизменных условиях любое время. При изменении же условий состояние равновесия нарушается, так как при этом скорости противоположных процессов изменяются в разной степени. Однако спустя некоторое время система снова приходит в состояние равновесия, но уже отвечающее новым изменившимся условиям.
Смещение равновесия в зависимости от изменения условий в общем виде определяется принципом Ле-Шателье (или принципом подвижного равновесия): если на систему, находящуюся в равновесии, оказывать воздействие извне путем изменения какого-либо из условий, определяющих положение равновесия, то оно смещается в направлении того процесса, протекание которого ослабляет эффект произведенного воздействия.
Так, повышение температуры вызывает смещение равновесия в направлении того из процессов, течение которого сопровождается поглощением тепла, а понижение температуры действует в противоположном направлении. Подобно этому повышение давления смещает равновесие в направлении процесса, сопровождающегося уменьшением объема, а понижение давления действует в противоположную сторону. Например, в равновесной системе 3Н 2 +N 2 2H 3 N, ∆H o = -46,2 кДж повышение температуры усиливает разложение H 3 N на водород и азот, так как этот процесс эндотермический. Повышение давления смещает равновесие в сторону образования H 3 N, ибо при этом уменьшается объем.
Если в систему, находящуюся в состоянии равновесия, добавить некоторое количество какого-либо из веществ, участвующих в реакции (или наоборот, удалить из системы), то скорости прямой и обратной реакций изменяются, но постепенно снова уравниваются. Иными словами, система снова приходит к состоянию химического равновесия. В этом новом состоянии равновесные концентрации всех веществ, присутствующих в системе, будут отличаться от первоначальных равновесных концентраций, но соотношение между ними останется прежним. Таким образом, в системе, находящейся в состоянии равновесия, нельзя изменить концентрацию одного из веществ, не вызвав изменения концентраций всех остальных.
В соответствии с принципом Ле Шателье введение в равновесную систему дополнительных количеств какого-либо реагента вызывает сдвиг равновесия в том направлении, при котором концентрация этого вещества уменьшается и соответственно увеличивается концентрация продуктов его взаимодействия.
Изучение химического равновесия имеет большое значение как для теоретических исследований, так и для решения практических задач. Определяя положение равновесия для различных температур и давлений, можно выбрать наиболее благоприятные условия проведения химического процесса. При окончательном выборе условий проведения процесса учитывают также их влияние на скорость процесса.
Пример 1. Вычисление константы равновесия реакции по равновесным концентрациям реагирующих веществ.
Вычислите константу равновесия реакции А+В 2С, если равновесные концентрации [А]=0,3моль∙л -1 ; [В]=1,1моль∙л -1 ; [С]=2,1моль∙л -1 .
Решение. Выражение константы равновесия для данной реакции имеет вид: . Подставим сюда указанные в условии задачи равновесные концентрации: =5,79.
Пример 2. Вычисление равновесных концентраций реагирующих веществ. Реакция протекает по уравнению А+2В С.
Определите равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В соответственно равны 0,5 и 0,7 моль∙л -1 , а константа равновесия реакции К р =50.
Решение. На каждый моль веществ А и В образуется 2 моль вещества С. Если понижение концентрации веществ А и В обозначить через Х моль, то увеличение концентрации вещества будет равно 2Х моль. Равновесные концентрации реагирующих веществ будут:
С А =(о,5-х)моль∙л -1 ; С В =(0,7-х)моль∙л -1 ; С С =2х моль∙л -1
х 1 =0,86; х 2 =0,44
По условию задачи справедливо значение х 2 . Отсюда равновесные концентрации реагирующих веществ равны:
С А =0,5-0,44=0,06моль∙л -1 ; С В =0,7-0,44=0,26моль∙л -1 ; С С =0,44∙2=0,88моль∙л -1 .
Пример 3. Определение изменения энергии Гиббса ∆G o реакции по значению константы равновесия К р. Рассчитайте энергию Гиббса и определите возможность протекания реакции СО+Cl 2 =COCl 2 при 700К, если константа равновесия равна Кр=1,0685∙10 -4 . Парциальное давление всех реагирующих веществ одинаково и равно 101325Па.
Решение. ∆G 700 =2,303∙RT ![]() .
.
Для данного процесса:
Так как ∆Gо
Пример 4. Смещение химического равновесия. В каком направлении сместится равновесие в системе N 2 +3H 2 2NH 3 -22ккал:
а) при увеличении концентрации N 2 ;
б) при увеличении концентрации Н 2 ;
в) при повышении температуры;
г)при уменьшении давления?
Решение.Увеличение концентрации веществ, стоящих в левой части уравнения реакции, по правилу Ле-Шателье должно вызвать процесс, стремящийся ослабить оказанное воздействие, привести к уменьшению концентраций, т.е. равновесие сместится вправо (случаи а и б).
Реакция синтеза аммиака – экзотермическая. Повышение температуры вызывает смещение равновесия влево – в сторону эндотермической реакции, ослабляющей оказанное воздействие (случай в).
Уменьшение давления (случай г) будет благоприятствовать реакции, ведущей к увеличению объема системы, т.е. в сторону образования N 2 и Н 2 .
Пример 5.Во сколько раз изменится скорость прямой и обратной реакции в системе 2SO 2 (г) + О 2 (г) 2SO 3 (r) если объем газовой смеси уменьшится в три раза? В какую сторону сместится равновесие системы?
Решение.Обозначим концентрации реагирующих веществ: =а, =b,=с.Согласно закону действующих масс, скорости прямой и обратной реакций до изменения объема равны
v пр = Ка 2 b, v обр = К 1 с 2
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: = 3а,[О 2 ] = 3b; = 3с.При новых концентрациях скорости v» np прямой и обратной реакций:
v» np = K(3a) 2 (3b) = 27 Ka 2 b; v o 6 p = K 1 (3c) 2 = 9K 1 c 2 .
![]() ;
; ![]()
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной — только в девять раз. Равновесие системы сместилось в сторону образования SO 3 .
Пример 6.Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70 0 С, если температурный коэффициент реакции равен 2.
Решение.Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле
Следовательно, скорость реакции при 70°С большескорости реакции при 30° С в 16 раз.
Пример 7.Константа равновесия гомогенной системы
СО(г) + Н 2 О(г) СО 2 (г) + Н 2 (г) при 850°С равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО] ИСХ = 3 моль/л, [Н 2 О] ИСХ = 2 моль/л.
Решение.При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
V np = К 1[СО][Н 2 О]; V o б p = К 2 [СО 2 ][Н 2 ];
![]()
В условии задачи даны исходные концентрации, тогда как в выражение К рвходят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрация [СО 2 ] Р = хмоль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также хмоль/л. По столько же молей (хмоль/л) СО и Н 2 О расходуется для образования по хмолей СО 2 и Н 2 . Следовательно, равновесные концентрации всех четырех веществ (моль/л):
[СО 2 ] Р = [Н 2 ] р = х;[СО] Р = (3 –х); P =(2-х).
Зная константу равновесия, находим значение х,а затем исходные концентрации всех веществ:
![]() ; х 2 =6-2х-3х + х 2; 5х = 6, л = 1,2 моль/л.
; х 2 =6-2х-3х + х 2; 5х = 6, л = 1,2 моль/л.
Химическим равновесием называется такоесостояние обратимой химической реакции
aA + bB = cC + dD,
при котором с течением времени не происходитизменения концентраций реагирующих веществ вреакционной смеси. Состояние химическогоравновесия характеризуется константойхимического равновесия:
где C i – концентрации компонентов в равновеснойидеальной смеси.
Константа равновесия может быть выражена такжечерез равновесные мольные доли X iкомпонентов:
Для реакций, протекающих в газовой фазе,константу равновесия удобно выражать черезравновесные парциальные давления P iкомпонентов:
Для идеальных газов P i = C i RT и P i= X i P, где P – общее давление, поэтому K P,K C и K X связаны следующимсоотношением:
K P = K C (RT) c+d–a–b = K X Pc+d–a–b. (9.4)
Константа равновесия связана с r G o химическойреакции:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
Изменение r G или r F вхимической реакции при заданных (не обязательноравновесных) парциальных давлениях P iили концентрациях C i компонентов можнорассчитать по уравнению изотермы химическойреакции (изотермы Вант-Гоффа):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
Согласно принципу Ле Шателье, если насистему, находящуюся в равновесии, оказатьвнешнее воздействие, то равновесие сместитсятак, чтобы уменьшить эффект внешнеговоздействия. Так, повышение давления сдвигаетравновесие в сторону уменьшения количествамолекул газа. Добавление в равновесную смеськакого-либо компонента реакции сдвигаетравновесие в сторону уменьшения количестваэтого компонента. Повышение (или понижение)температуры сдвигает равновесие в сторонуреакции, протекающей с поглощением (выделением)теплоты.
Количественно зависимость константыравновесия от температуры описываетсяуравнением изобары химической реакции (изобарыВант-Гоффа)
![]() (9.9)
(9.9)
и изохоры химической реакции (изохорыВант-Гоффа)
![]() . (9.10)
. (9.10)
Интегрирование уравнения (9.9) в предположении,что r H реакции независит от температуры (что справедливо в узкихинтервалах температур), дает:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
где C –константа интегрирования. Такимобразом, зависимость ln K P от 1/Тдолжна быть линейной, а наклон прямой равен – r H/R.
Интегрирование в пределах K 1 , K 2 ,и T 1, T 2 дает:
 (9.13)
(9.13)
 (9.14)
(9.14)
По этому уравнению, зная константы равновесияпри двух разных температурах, можно рассчитать r Hреакции. Соответственно, зная r H реакциии константу равновесия при одной температуре,можно рассчитать константу равновесия придругой температуре.
ПРИМЕРЫ
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K. f G oдля CO(г) и CH 3 OH(г) при 500 К равны –155.41 кДж.моль –1 и –134.20 кДж. моль –1соответственно.
Решение. G oреакции:
r G o= f G o(CH 3 OH)– f G o(CO)= –134.20 – (–155.41) = 21.21 кДж. моль –1 .
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
Пример 9-2. Константа равновесия реакции
равна K P = 1.64 10 –4 при 400 o C. Какое общеедавление необходимо приложить к эквимолярнойсмеси N 2 и H 2 , чтобы 10% N 2превратилось в NH 3 ? Газы считать идеальными.
Решение. Пусть прореагировало моль N 2 . Тогда
N 2 (г) + 3H 2 (г) = 2NH 3 (г)Исходное количество 1 1 Равновесное количество 1– 1–3 2 (Всего: 2–2)Равновесная мольная доля:
Следовательно, K X = 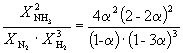 и K P = K X . P –2=
и K P = K X . P –2=  .
.
Подставляя = 0.1 вполученную формулу, имеем
1.64 10 –4 =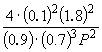 , откуда P = 51.2 атм.
, откуда P = 51.2 атм.
Пример 9-3. Константа равновесия реакции
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K равна K P = 6.09 10 –3 . Реакционная смесь,состоящая из 1 моль CO, 2 моль H 2 и 1 мольинертного газа (N 2) нагрета до 500 K и общегодавления 100 атм. Рассчитать состав равновеснойсмеси.
Решение. Пусть прореагировало моль CO. Тогда
CO(г) + 2H 2 (г) = CH 3 OH(г)Исходное количество: 1 2 0Равновесное количество: 1– 2–2 Всего в равновесной смеси: 3–2 моль компонентов + 1 моль N 2 = 4–2 мольРавновесная мольная доля
Следовательно, K X =  и K P = K X . P –2 =
и K P = K X . P –2 = ![]() .
.
Таким образом, 6.09 10 –3= ![]() .
.
Решая это уравнение, получаем = 0.732. Соответственно, мольные доливеществ в равновесной смеси равны: = 0.288, = 0.106, = 0.212 и = 0.394.
Пример 9-4. Для реакции
N 2 (г) + 3H 2 (г) = 2NH 3 (г)
при 298 К K P = 6.0 10 5 , а f H o(NH 3) = –46.1 кДж. моль –1 . Оценитьзначение константы равновесия при 500 К.
Решение. Стандартная мольная энтальпияреакции равна
r H o=2 f H o(NH 3)= –92.2 кДж. моль –1 .
Согласно уравнению (9.14), 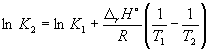 =
=
Ln (6.0 10 5) + ![]() = –1.73, откуда K 2 =0.18.
= –1.73, откуда K 2 =0.18.
Отметим, что константа равновесияэкзотермической реакции уменьшается с ростомтемпературы, что соответствует принципу ЛеШателье.
ЗАДАЧИ
- При 1273 К и общем давлении 30 атм в равновесной смеси
- При 2000 o C и общем давлении 1 атм 2% воды диссоциировано на водород и кислород. Рассчитать константу равновесия реакции
- Константа равновесия реакции
- Константа равновесия реакции
- Сосуд объемом 3 л, содержащий 1.79 10 –2 моль I 2 , нагрели до 973 K. Давление в сосуде при равновесии оказалось равно 0.49 атм. Считая газы идеальными, рассчитать константу равновесия при 973 K для реакции
- Для реакции
- Для реакции
- Сосуд объемом 1 л, содержащий 0.341 моль PCl 5 и 0.233 моль N 2 , нагрели до 250 o C. Общее давление в сосуде при равновесии оказалось равно 29.33 атм. Считая все газы идеальными, рассчитать константу равновесия при 250 o C для протекающей в сосуде реакции
- Константа равновесия реакции
- При 25 o C f G o(NH 3) = –16.5 кДж. моль –1 . Рассчитать r G реакции образования NH 3 при парциальных давлениях N 2 , H 2 и NH 3 , равных 3 атм, 1 атм и 4 атм соответственно. В какую сторону реакция будет идти самопроизвольно при этих условиях?
- Экзотермическая реакция
- Константа равновесия газофазной реакции изомеризации борнеола (C 10 H 17 OH) в изоборнеол равна 0.106 при 503 K. Смесь 7.5 г борнеола и 14.0 г изоборнеола поместили в сосуд объемом 5 л и выдерживали при 503 K до достижения равновесия. Рассчитать мольные доли и массы борнеола и изоборнеола в равновесной смеси.
- Равновесие в реакции
- Рассчитать общее давление, которое необходимо приложить к смеси 3 частей H 2 и 1 части N 2 , чтобы получить равновесную смесь, содержащую 10% NH 3 по объему при 400 o C. Константа равновесия для реакции
- При 250 o C и общем давлении 1 атм PCl 5 диссоциирован на 80% по реакции
- При 2000 o C для реакции
- Рассчитать стандартную энтальпию реакции, для которой константа равновесия а) увеличивается в 2 раза, б) уменьшается в 2 раза при изменении температуры от 298 К до 308 К.
- Зависимость константы равновесия реакции 2C 3 H 6 (г) = C 2 H 4 (г) + C 4 H 8 (г) от температуры между 300 К и 600 К описывается уравнением
CO 2 (г) + C(тв) = 2CO(г)
содержится 17% (по объему) CO 2 . Сколько процентов CO 2 будет содержаться в газе при общем давлении 20 атм? При каком давлении в газе будет содержаться 25% CO 2 ?
H 2 O(г) = H 2 (г) + 1/2O 2 (г) при этих условиях.
CO(г) + H 2 O(г) = CO 2 (г) + H 2 (г)
при 500 o C равна K p = 5.5. Смесь, состоящая из 1 моль CO и 5 моль H 2 O, нагрели до этой температуры. Рассчитать мольную долю H 2 O в равновесной смеси.
N 2 O 4 (г) = 2NO 2 (г)
при 25 o C равна K p = 0.143. Рассчитать давление, которое установится в сосуде объемом 1 л, в который поместили 1 г N 2 O 4 при этой температуре.
I 2 (г) = 2I (г).
при 250 o C r G o = –2508 Дж. моль –1 . При каком общем давлении степень превращения PCl 5 в PCl 3 и Cl 2 при 250 o C составит 30%?
2HI(г) = H 2 (г) + I 2 (г)
константа равновесия K P = 1.83 10 –2 при 698.6 К. Сколько граммов HI образуется при нагревании до этой температуры 10 г I 2 и 0.2 г H 2 в трехлитровом сосуде? Чему равны парциальные давления H 2 , I 2 и HI?
PCl 5 (г) = PCl 3 (г) + Cl 2 (г)
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K равна K P = 6.09 10 –3 . Рассчитать общее давление, необходимое для получения метанола с 90% выходом, если CO и H 2 взяты в соотношении 1: 2.
CO(г) + 2H 2 (г) = CH 3 OH(г)
находится в равновесии при 500 K и 10 бар. Если газы идеальные, как повлияют на выход метанола следующие факторы: а) повышение T; б) повышение P; в) добавление инертного газа при V = const; г) добавление инертного газа при P = const; д) добавление H 2 при P = const?
2NOCl(г) = 2NO(г) + Cl 2 (г)
устанавливается при 227 o C и общем давлении 1.0 бар, когда парциальное давление NOCl равно 0.64 бар (изначально присутствовал только NOCl). Рассчитать r G oдля реакции. При каком общем давлении парциальное давление Cl 2 будет равно 0.10 бар?
N 2 (г) + 3H 2 (г) = 2NH 3 (г)
при 400 o C равна K = 1.60 10 –4 .
PCl 5 (г) = PCl 3 (г) + Cl 2 (г).
Чему будет равна степень диссоциации PCl 5 , если в систему добавить N 2 , чтобы парциальное давление азота было равно 0.9 атм? Общее давление поддерживается равным 1 атм.
N 2 (г) + O 2 (г) = 2NO(г)
K p = 2.5 10 –3 . В равновесной смеси N 2 , O 2 , NO и инертного газа при общем давлении 1 бар содержится 80% (по объему) N 2 и 16% O 2 . Сколько процентов по объему составляет NO? Чему равно парциальное давление инертного газа?
ln K = –1.04 –1088 /T +1.51 10 5 /T 2 .
Состояниехим. равновесия— это состояние прикотором хим.потенциал продуктов иисходных в-в равны между собой, с учётомстехиометрии процесса.
О химическомравновесии можно говорить при выполнениидвух условий:
Скорости прямой и обратной реакции равны между собой.
Равновесие существует если при оказании внешнего воздействия, а затем при его снятии система возвращается в исходное состояние.
11.Закон действия масс.
Припостоянной температуре скоростьхимической реакции прямо пропорциональнапроизведению концентраций реагирующихвеществ, взятых в степенях, равныхстехиометрическим коэффициентам вуравнении реакции.
Например,для реакции синтеза аммиака:
N 2 +3H 2 =2NH 3
закондействующих масс имеет вид:
К с = 2 / 3
12.Константа равновесия в гомогенной системе. Способы выражения константы равновесия.
константаравновесия – этопостоянная величина, равная отношениюпроизведений равновесных концентрацийконечных и исходных участников реакции,взятых в степенях, соответствующихстехиометрическим коэффициентам
Гомогенныминазываются реакции, протекающиев одной фазе: в смеси газов, в жидком илииногда в твёрдом растворе.
Способывыражения константы равновесия
Есликонцентрации веществ, участвующих вреакции, выражены в молярных единицахмолярности, т.е. в моль/л, то она обычнообозначается Кс
Длягомогенной газовой реакции константуравновесия удобнее выразить черезпарциальные давления веществ:

Иногдаконстанту равновесия удобно выразитьне через парциальные давления иконцентрации, а через количества веществ: или через соответствующие мольные доли:
или через соответствующие мольные доли:
Вобщем случае константы равновесия Кс,Кр, Кnи К N различны.
13.ПринципЛе-Шателье-Брауна.
если на систему,находящуюся в равновесии, оказываетсявнешнее воздействие, то равновесиесмещается в том направлении, котороеослабляет внешнее воздействие.
14.Уравнение изобары Вант-Гоффа.
данноевыражение позволяет качественно оценитьвлияние Т на равновесие и константуравновесия.
15.Фаза.
Фазойназывается– гомогенная частьгетерогенной системы, имеющая реальнуюграницу раздела, внутри которой всесвойства могут меняться непрерывно, апри переходе через которую скачком.
16.Составляющиевещества и компоненты.
Компонентомназывается– минимальное количествосоставляющих в-в, достаточное дляописания состояния систем.
Составляющимивеществаминазываются –вещества,входящие в состав системы, которую можновыделить обычными препаратными методамии которые могут существовать вне системысколько угодно.
17.Правилофаз Гиббса.
Числостепеней свободы равновеснойтермодинамической системы, на которуюиз внешних факторов влияют толькотемпература и давление, равно числунезависимых компонентов С=К-Ф+n(числовнешних параметров)
Правилофаз показывает, что число степенейсвободы возрастает с увеличением числакомпонентов и уменьшается с увеличениемчисла фаз системы.
18.Условияфазового равновесия в системе.
В гетерогеннойсистеме имеется фазовое равновесие,если между фазами существуют следующиевиды равновесий:
Термическое(равенство температур)
Механическое(равенство давлений)
Химическоев отношении каждого компонента
19.уравнениеКлайперона-Клаузиуса
Где,–ΔV—изменение объёма вещества при переходеего из первой фазы во вторую, Т –температура перехода,ΔH –изменение энтропии и энтальпии веществапри переходе 1 моля вещества из однойфазы в другую
Онопозволяет оценить как меняется температураили давление при фазовом переходе приизменении 2 параметра.
20. диаграмма состоянияводы
Зависимость между величинами,характеризующими состояние системы, ифазовыми превращениями в системе переходиз твердого состояния в жидкое,изжидкого в газообразное
21.Истинныерастворы. Способы выражения концентрациираствора. Расчёт молярной и массовойдоли вещества и молярной концентрациивещества в растворе.
Истинный раствор— это разновидность раствора, в которомразмеры частиц растворенного веществапредельно малы и сопоставимы с размеромчастиц растворителя.
Растворы бывают газообразные(газовые смеси),жидкиеитвердые.Газообразным раствором является воздух.Морская вода – смесь солей в воде –жидкий раствор. Твердые растворы –металлические сплавы. Растворы состоятиз растворителя и растворенного вещества(веществ).
Раствором называетсятвердая или жидкая гомогенная система,состоящая из двух или более составныхчастей.
Растворителемсчитается –в-во, определяющее агрегатное состояниераствора или в-во, которого больше пообъёму или массе.
Способывыражения концентрации растворов.
Концентрация раствора–это масса или количество растворенноговещества в определенном количестве,массе или объеме раствора или растворителя.
1) Массоваядоля(wi)– это масса растворенного вещества,содержащаяся в 100 граммах раствора.
2) Молярнаядоля(мольная) –X i –кол-во моль компонента, содержащиеся в1 моль р-ра.
3) Моляльная концентрация(моляльность)mi –количествомолей растворенного вещества, содержащихсяв 1 кграстворителя [моль/кг].
4) МолярнаяконцентрацияС i – количествомолей растворенного вещества, содержащаясяв 1 литре или в 1дм3 раствора [моль/л].
