Sistemin denge sabitinin hesaplanması. Kimyasal Denge
Devamlı kimyasal Denge
Çoğunluk kimyasal reaksiyonlar geri dönüşümlüdür, yani aynı anda zıt yönlerde akar. İleri ve geri reaksiyonların aynı hızda gerçekleştiği durumlarda kimyasal denge oluşur. Örneğin, tersinir bir homojen reaksiyonda: H2 (g) + I2 (g) ↔ 2HI (g), kütle etki yasasına göre ileri ve geri reaksiyon oranlarının oranı, konsantrasyonların oranına bağlıdır. reaktantların sayısı, yani: ileri reaksiyonun hızı: υ 1 = k 1 [H 2 ]. Ters reaksiyon hızı: υ 2 = k 2 2.
H2 ve I2 başlangıç maddeleriyse, ilk anda ileri reaksiyonun hızı başlangıç konsantrasyonlarına göre belirlenir ve ters reaksiyonun hızı sıfırdır. H2 ve I2 tükenip HI oluştukça ileri reaksiyonun hızı azalır, geri reaksiyonun hızı artar. Bir süre sonra her iki oran da eşitlenir ve sistemde kimyasal denge kurulur; birim zamanda üretilen ve tüketilen HI moleküllerinin sayısı aynı olur.
Kimyasal dengede ileri ve geri reaksiyonların hızları V 1 = V 2'ye eşit olduğundan k 1 = k 2 2 olur.
k 1 ve k 2 belirli bir sıcaklıkta sabit olduğundan oranları sabit olacaktır. Bunu K ile gösterirsek şunu elde ederiz:

K'ya kimyasal denge sabiti denir ve verilen denkleme kütle hareketi yasası denir (Guldberg - Waale).
Genel durumda, aA+bB+…↔dD+eE+… formundaki bir reaksiyon için denge sabiti şuna eşittir: ![]() . Gaz halindeki maddeler arasındaki etkileşim için, reaktanların denge kısmi basınçları p ile temsil edildiği ifade sıklıkla kullanılır. Bahsedilen reaksiyon için
. Gaz halindeki maddeler arasındaki etkileşim için, reaktanların denge kısmi basınçları p ile temsil edildiği ifade sıklıkla kullanılır. Bahsedilen reaksiyon için  .
.
Denge durumu, belirli koşullar altında reaksiyonun kendiliğinden ilerleyeceği sınırı karakterize eder (∆G<0). Если в системе наступило химическое равновесие, то дальнейшее изменение изобарного потенциала происходить не будет, т.е. ∆G=0.
Denge konsantrasyonları arasındaki ilişki, hangi maddelerin başlangıç maddesi olarak alındığına bağlı değildir (örneğin, H2 ve I2 veya HI), yani. Denge durumuna her iki taraftan da yaklaşılabilir.
Kimyasal denge sabiti reaktiflerin doğasına ve sıcaklığa bağlıdır; Denge sabiti basınca (çok yüksekse) veya reaktiflerin konsantrasyonuna bağlı değildir.
Sıcaklık, entalpi ve entropi faktörlerinin denge sabiti üzerindeki etkisi. Denge sabiti, ∆Go kimyasal reaksiyonunun standart izobarik-izotermal potansiyelindeki değişiklik ile ∆G o =-RT ln K basit denklemiyle ilişkilidir.
∆G o'nun (∆G o) büyük negatif değerlerinin olduğunu gösterir.<<0) отвечают большие значения К, т.е. в равновесной смеси преобладают продукты взаимодействия. Если же ∆G o характеризуется большими положительными значениями (∆G o >>0), bu durumda başlangıç maddeleri denge karışımında baskındır. Bu denklem, ∆G o değerinden K'nın ve ardından reaktiflerin denge konsantrasyonlarının (kısmi basınçlar) hesaplanmasını mümkün kılar. ∆G o =∆Н o -Т∆S o olduğunu hesaba katarsak, bir miktar dönüşümden sonra şunu elde ederiz: ![]() . Bu denklemden denge sabitinin sıcaklık değişimlerine karşı çok duyarlı olduğu açıktır. Reaktiflerin doğasının denge sabiti üzerindeki etkisi, onun entalpi ve entropi faktörlerine bağımlılığını belirler.
. Bu denklemden denge sabitinin sıcaklık değişimlerine karşı çok duyarlı olduğu açıktır. Reaktiflerin doğasının denge sabiti üzerindeki etkisi, onun entalpi ve entropi faktörlerine bağımlılığını belirler.
Denklemle ifade edilen amonyak üretim sürecine dönelim:
N2(g) + 3H2(g) → 2NH3(g)
Kapalı bir hacimde bulunan azot ve hidrojen birleşerek amonyak oluşturur. Bu süreç ne kadar sürecek? Reaktiflerden herhangi biri bitene kadar bunu varsaymak mantıklıdır. Ancak gerçek hayatta bu tamamen doğru değildir. Gerçek şu ki, reaksiyonun başlamasından bir süre sonra ortaya çıkan amonyak nitrojen ve hidrojene ayrışmaya başlayacak, yani ters bir reaksiyon başlayacak:
2NH3 (g) → N2 (g) + 3H2 (g)
Aslında kapalı bir hacimde birbirine zıt iki reaksiyon aynı anda gerçekleşecektir. Bu nedenle bu süreç aşağıdaki denklemle yazılır:
N 2 (g) + 3H2 (g) ↔ 2NH3 (g)
Çift ok reaksiyonun iki yönde ilerlediğini gösterir. Azot ve hidrojenin birleşme reaksiyonuna denir doğrudan reaksiyon. Amonyak ayrışma reaksiyonu - ters tepki.
Sürecin en başında doğrudan reaksiyon oranı çok yüksektir. Ancak zamanla reaktiflerin konsantrasyonları azalır ve amonyak miktarı artar - sonuç olarak ileri reaksiyonun hızı azalır ve ters reaksiyonun hızı artar. İleri ve geri reaksiyonların oranlarının karşılaştırıldığı bir zaman gelir; kimyasal denge veya dinamik denge oluşur. Dengede hem ileri hem de geri reaksiyonlar meydana gelir, ancak hızları aynıdır, dolayısıyla hiçbir değişiklik fark edilmez.
Denge sabiti
Farklı tepkiler farklı şekillerde ilerler. Bazı reaksiyonlarda, denge oluşmadan önce oldukça fazla sayıda reaksiyon ürünü oluşur; diğerlerinde - çok daha az. Dolayısıyla belirli bir denklemin kendi denge sabitine sahip olduğunu söyleyebiliriz. Bir reaksiyonun denge sabitini bilerek, kimyasal dengenin oluştuğu reaktantların ve reaksiyon ürünlerinin bağıl miktarlarını belirlemek mümkündür.
Bazı reaksiyonların şu denklemle tanımlanmasına izin verin: aA + bB = cC + dD
- a, b, c, d - reaksiyon denkleminin katsayıları;
- A, B, C, D - maddelerin kimyasal formülleri.
Denge sabiti:
[C] c [D] d K = ———————— [A] a [B] b
Köşeli parantezler formülün maddelerin molar konsantrasyonlarını içerdiğini gösterir.
Denge sabiti ne diyor?
Oda sıcaklığında amonyak sentezi için K = 3,5·10 8. Bu oldukça büyük bir sayıdır ve amonyak konsantrasyonu geri kalan başlangıç malzemelerinden çok daha yüksek olduğunda kimyasal dengenin oluşacağını gösterir.
Gerçek amonyak üretiminde teknoloji uzmanının görevi mümkün olan en yüksek denge katsayısını elde etmektir, yani doğrudan reaksiyonun tamamlanmasını sağlar. Bu nasıl başarılabilir?
Le Chatelier'in ilkesi
Le Chatelier'in ilkesi okur:
Bunu nasıl anlayabilirim? Her şey çok basit. Dengeyi bozmanın üç yolu vardır:
- maddenin konsantrasyonunun değiştirilmesi;
- sıcaklığın değiştirilmesi;
- basıncı değiştiriyor.
Amonyak sentezi reaksiyonu dengede olduğunda aşağıdaki gibi gösterilebilir (reaksiyon ekzotermiktir):
N 2 (g) + 3H 2 (g) → 2NH 3 (g) + Isı
Konsantrasyonu değiştirme
Dengeli bir sisteme ilave nitrojen ekleyelim. Bu dengeyi bozacaktır:

İleri reaksiyon daha hızlı ilerlemeye başlayacak çünkü nitrojen miktarı arttı ve daha fazlası reaksiyona girdi. Bir süre sonra kimyasal denge yeniden oluşacak, ancak nitrojen konsantrasyonu hidrojen konsantrasyonundan daha büyük olacaktır:

Ancak sistemi başka bir şekilde sol tarafa "çarpmak" mümkündür - sağ tarafı "hafifleterek", örneğin sistemden amonyağı oluştuğunda çıkararak. Böylece amonyak oluşumunun doğrudan reaksiyonu yine baskın olacaktır.
Sıcaklığın değiştirilmesi
Sıcaklık değiştirilerek “terazimizin” sağ tarafı değiştirilebilir. Sol tarafın "daha ağır basması" için sağ tarafı "hafifletmeniz" gerekir - sıcaklığı düşürün:

Basıncın değiştirilmesi
Basıncın kullanıldığı bir sistemdeki dengeyi yalnızca gazlarla reaksiyonlarda bozmak mümkündür. Basıncı arttırmanın iki yolu vardır:
- sistemin hacmini azaltmak;
- inert gazın tanıtılması.
Basınç arttıkça moleküler çarpışmaların sayısı artar. Aynı zamanda sistemdeki gazların konsantrasyonu artar ve ileri ve geri reaksiyonların oranları değişir - denge bozulur. Dengeyi yeniden sağlamak için sistem basıncı düşürmeye "dener".
Amonyak sentezi sırasında 4 molekül nitrojen ve hidrojenden iki molekül amonyak oluşur. Sonuç olarak, gaz moleküllerinin sayısı azalır - basınç düşer. Sonuç olarak basınç artırıldıktan sonra dengeye ulaşmak için ileri reaksiyonun hızı artar.
Özetle. Le Chatelier ilkesine göre amonyak üretimi şu şekilde artırılabilir:
- reaktiflerin konsantrasyonunun arttırılması;
- reaksiyon ürünlerinin konsantrasyonunun azaltılması;
- reaksiyon sıcaklığının düşürülmesi;
- reaksiyonun meydana geldiği basıncı arttırır.
Çoğu kimyasal reaksiyon geri dönüşümlüdür, yani. aynı anda zıt yönlerde akar. İleri ve geri reaksiyonların aynı hızda gerçekleştiği durumlarda kimyasal denge oluşur. Örneğin, tersinir bir homojen reaksiyonda: H2 (g) + I2 (g) ↔ 2HI (g), kütle etki yasasına göre ileri ve geri reaksiyon oranlarının oranı, konsantrasyonların oranına bağlıdır. reaktantların sayısı, yani: ileri reaksiyonun hızı: υ 1 = k 1 [H 2 ]. Ters reaksiyon hızı: υ 2 = k 2 2.
H2 ve I2 başlangıç maddeleriyse, ilk anda ileri reaksiyonun hızı başlangıç konsantrasyonlarına göre belirlenir ve ters reaksiyonun hızı sıfırdır. H2 ve I2 tükenip HI oluştukça ileri reaksiyonun hızı azalır, geri reaksiyonun hızı artar. Bir süre sonra her iki oran da eşitlenir ve sistemde kimyasal denge kurulur; birim zamanda üretilen ve tüketilen HI moleküllerinin sayısı aynı olur.
Kimyasal dengede ileri ve geri reaksiyonların hızları V 1 = V 2'ye eşit olduğundan k 1 = k 2 2 olur.
k 1 ve k 2 belirli bir sıcaklıkta sabit olduğundan oranları sabit olacaktır. Bunu K ile gösterirsek şunu elde ederiz:

K'ya kimyasal denge sabiti denir ve verilen denkleme kütle hareketi yasası denir (Guldberg - Waale).
Genel durumda, aA+bB+…↔dD+eE+… formundaki bir reaksiyon için denge sabiti şuna eşittir: ![]() . Gaz halindeki maddeler arasındaki etkileşim için, reaktanların denge kısmi basınçları p ile temsil edildiği ifade sıklıkla kullanılır. Bahsedilen reaksiyon için
. Gaz halindeki maddeler arasındaki etkileşim için, reaktanların denge kısmi basınçları p ile temsil edildiği ifade sıklıkla kullanılır. Bahsedilen reaksiyon için  .
.
Denge durumu, belirli koşullar altında reaksiyonun kendiliğinden ilerleyeceği sınırı karakterize eder (∆G<0). Если в системе наступило химическое равновесие, то дальнейшее изменение изобарного потенциала происходить не будет, т.е. ∆G=0.
Denge konsantrasyonları arasındaki ilişki, hangi maddelerin başlangıç maddesi olarak alındığına bağlı değildir (örneğin, H2 ve I2 veya HI), yani. Denge durumuna her iki taraftan da yaklaşılabilir.
Kimyasal denge sabiti reaktiflerin doğasına ve sıcaklığa bağlıdır; Denge sabiti basınca (çok yüksekse) veya reaktiflerin konsantrasyonuna bağlı değildir.
Sıcaklık, entalpi ve entropi faktörlerinin denge sabiti üzerindeki etkisi. Denge sabiti, ∆Go kimyasal reaksiyonunun standart izobarik-izotermal potansiyelindeki değişiklik ile ∆G o =-RT ln K basit denklemiyle ilişkilidir.
∆G o'nun (∆G o) büyük negatif değerlerinin olduğunu gösterir.<<0) отвечают большие значения К, т.е. в равновесной смеси преобладают продукты взаимодействия. Если же ∆G o характеризуется большими положительными значениями (∆G o >>0), bu durumda başlangıç maddeleri denge karışımında baskındır. Bu denklem, ∆G o değerinden K'nın ve ardından reaktiflerin denge konsantrasyonlarının (kısmi basınçlar) hesaplanmasını mümkün kılar. ∆G o =∆Н o -Т∆S o olduğunu hesaba katarsak, bir miktar dönüşümden sonra şunu elde ederiz: ![]() . Bu denklemden denge sabitinin sıcaklık değişimlerine karşı çok duyarlı olduğu açıktır. Reaktiflerin doğasının denge sabiti üzerindeki etkisi, onun entalpi ve entropi faktörlerine bağımlılığını belirler.
. Bu denklemden denge sabitinin sıcaklık değişimlerine karşı çok duyarlı olduğu açıktır. Reaktiflerin doğasının denge sabiti üzerindeki etkisi, onun entalpi ve entropi faktörlerine bağımlılığını belirler.
Le Chatelier'in ilkesi
Kimyasal denge durumu, herhangi bir zamanda verilen sabit koşullar altında korunur. Koşullar değiştiğinde denge durumu bozulur, çünkü bu durumda zıt süreçlerin oranları değişen derecelerde değişir. Ancak bir süre sonra sistem tekrar denge durumuna ulaşır, ancak bu sefer değişen yeni koşullara karşılık gelir.
Koşullardaki değişikliklere bağlı olarak dengenin yer değiştirmesi genellikle Le Chatelier ilkesi (veya hareketli denge ilkesi) ile belirlenir: Dengedeki bir sistem, denge konumunu belirleyen koşullardan herhangi birinin değiştirilmesiyle dışarıdan etkilenirse, süreç, üretilen etkinin etkisini zayıflatan sürecin gidişatına kayar.
Bu nedenle, sıcaklıktaki bir artış, ısı emiliminin eşlik ettiği süreçlerin yönünde dengede bir kaymaya neden olur ve sıcaklıktaki bir azalma ters yönde etki eder. Benzer şekilde, basınçtaki bir artış dengeyi hacimdeki bir azalmanın eşlik ettiği bir süreç yönünde kaydırır ve basınçtaki bir azalma ters yönde etki eder. Örneğin, 3H 2 +N 2 2H 3 N, ∆H o = -46,2 kJ denge sisteminde, sıcaklıktaki bir artış, bu işlem endotermik olduğundan H3 N'nin hidrojen ve nitrojene ayrışmasını arttırır. Basınçtaki bir artış, hacim azaldığı için dengeyi H3N oluşumuna doğru kaydırır.
Reaksiyona katılan maddelerden herhangi birinin belirli bir miktarı denge durumundaki bir sisteme eklenirse (veya tersine sistemden çıkarılırsa), ileri ve geri reaksiyonların oranları değişir, ancak yavaş yavaş yeniden eşitlenir. Başka bir deyişle sistem kimyasal denge durumuna geri döner. Bu yeni durumda, sistemdeki tüm maddelerin denge konsantrasyonları orijinal denge konsantrasyonlarından farklı olacak ancak aralarındaki oran aynı kalacaktır. Dolayısıyla dengedeki bir sistemde, diğer maddelerin derişiminde bir değişikliğe yol açmadan maddelerden birinin derişimini değiştirmek mümkün değildir.
Le Chatelier ilkesine uygun olarak, bir denge sistemine ilave miktarda reaktifin eklenmesi, bu maddenin konsantrasyonunun azaldığı yönde dengede bir kaymaya neden olur ve buna bağlı olarak etkileşimi ürünlerinin konsantrasyonu artar.
Kimyasal dengenin incelenmesi hem teorik araştırmalar hem de pratik problemlerin çözümü için büyük önem taşımaktadır. Çeşitli sıcaklık ve basınçlar için denge konumunu belirleyerek kimyasal işlem için en uygun koşulları seçmek mümkündür. Proses koşullarının nihai seçimi yapılırken bunların proses hızı üzerindeki etkisi de dikkate alınır.
Örnek 1. Reaktanların denge konsantrasyonlarından bir reaksiyonun denge sabitinin hesaplanması.
Denge konsantrasyonları [A] = 0,3 mol∙l -1 ise, A + B 2C reaksiyonunun denge sabitini hesaplayın; [V]=1.1mol∙1 -1; [C]=2.1mol∙l -1.
Çözüm. Bu reaksiyonun denge sabitinin ifadesi şu şekildedir: . Burada problem cümlesinde belirtilen denge konsantrasyonlarını yerine koyalım: =5.79.
Örnek 2. Reaksiyona giren maddelerin denge konsantrasyonlarının hesaplanması. Reaksiyon A + 2B C denklemine göre ilerler.
A ve B maddelerinin başlangıç konsantrasyonları sırasıyla 0,5 ve 0,7 mol∙l -1 ise ve reaksiyonun denge sabiti K p = 50 ise, reaksiyona giren maddelerin denge konsantrasyonlarını belirleyin.
Çözüm. A ve B maddelerinin her molü için 2 mol C maddesi oluşur. A ve B maddelerinin konsantrasyonundaki azalma X mol ile gösterilirse, maddenin konsantrasyonundaki artış 2X mol'e eşit olacaktır. Reaktanların denge konsantrasyonları şöyle olacaktır:
C A = (yaklaşık.5-x)mol∙l -1; C B = (0,7-x) mol∙l -1; C C =2x mol∙l -1
x1 =0,86; x 2 =0,44
Problemin koşullarına göre x 2 değeri geçerlidir. Dolayısıyla reaktanların denge konsantrasyonları şöyledir:
C A =0,5-0,44=0,06mol∙l -1; CB =0,7-0,44=0,26mol∙l -1; C C =0,44∙2=0,88mol∙l -1.
Örnek 3. Bir reaksiyonun Gibbs enerjisindeki ∆G o değişiminin denge sabiti K r'nin değeri ile belirlenmesi. Gibbs enerjisini hesaplayın ve denge sabiti Kp = 1,0685∙10 -4'e eşitse 700 K'de CO + Cl 2 = COCl 2 reaksiyonunun olasılığını belirleyin. Reaksiyona giren tüm maddelerin kısmi basıncı aynı ve 101325 Pa'ya eşittir.
Çözüm.∆G 700 =2,303∙RT ![]() .
.
Bu işlem için:
∆Go'dan beri<0, то реакция СО+Cl 2 COCl 2 при 700К возможна.
Örnek 4. Kimyasal dengede değişiklik. N 2 +3H 2 2NH3 -22kcal sisteminde denge hangi yöne kayacaktır:
a) artan N2 konsantrasyonuyla;
b) artan H2 konsantrasyonuyla;
c) artan sıcaklıkla;
d) basınç ne zaman azalır?
Çözüm. Le Chatelier kuralına göre reaksiyon denkleminin sol tarafındaki maddelerin konsantrasyonundaki bir artış, etkiyi zayıflatma eğiliminde olan ve konsantrasyonlarda bir azalmaya yol açan bir sürece neden olmalıdır; denge sağa kayacaktır (a ve b durumları).
Amonyak sentezinin reaksiyonu ekzotermiktir. Sıcaklıktaki bir artış, dengenin sola - endotermik reaksiyona doğru kaymasına neden olur ve etkiyi zayıflatır (c durumu).
Basınçtaki bir azalma (durum d), sistemin hacminde bir artışa yol açan bir reaksiyonu destekleyecektir; N 2 ve H 2 oluşumuna doğru.
Örnek 5. Gaz karışımının hacmi üç kat azalırsa 2SO 2 (g) + O 2 (g) 2SO 3 (r) sistemindeki ileri ve geri reaksiyon hızı kaç kez değişecektir? Sistemin dengesi hangi yöne kayacak?
Çözüm. Reaktiflerin konsantrasyonlarını gösterelim: = A, =B,=İle. Kütle etki kanununa göre hacim değişmeden önce ileri ve geri reaksiyonların hızları eşittir.
v pr = Ka 2 b, v arr = K 1 s 2
Homojen bir sistemin hacmi üç kat azaltıldığında, reaktanların her birinin konsantrasyonu üç kat artacaktır: = 3 A,[O2] = 3b; = 3'ler. Yeni konsantrasyonlarda ileri ve geri reaksiyonların hızı v" np:
v" np = K(3a) 2 (3b) = 27 Ka 2 b; v o 6 p = K 1 (3c) 2 = 9K 1 c 2.
![]() ;
; ![]()
Sonuç olarak, ileri reaksiyonun hızı 27 kat, ters reaksiyonun hızı ise yalnızca dokuz kat arttı. Sistemin dengesi SO3 oluşumuna doğru kaydı.
Örnek 6. Reaksiyonun sıcaklık katsayısı 2 ise, sıcaklık 30 0 C'den 70 0 C'ye çıktığında gaz fazında meydana gelen reaksiyonun hızının kaç kat artacağını hesaplayın.
Çözüm. Kimyasal reaksiyon hızının sıcaklığa bağımlılığı, aşağıdaki formüle göre ampirik Van't Hoff kuralı ile belirlenir.
Sonuç olarak 70°C'deki reaksiyon hızı, 30°C'deki reaksiyon hızından 16 kat daha fazladır.
Örnek 7. Homojen bir sistemin denge sabiti
850°C'de CO(g) + H 2 O(g) CO 2 (g) + H 2 (g) 1'e eşittir. Başlangıç konsantrasyonları şu ise, dengedeki tüm maddelerin konsantrasyonlarını hesaplayın: [CO] ISH = 3 mol/l, [H2O]RI = 2 mol/l.
Çözüm. Dengede ileri ve geri reaksiyonların hızları eşittir ve bu hızların sabitlerinin oranı sabittir ve verilen sistemin denge sabiti olarak adlandırılır:
V np = K 1[CO][H20]; V o b p = İLE 2 [C02][H2];
![]()
Problem ifadesinde başlangıç konsantrasyonları verilirken, ifadede Kr sistemdeki tüm maddelerin yalnızca denge konsantrasyonlarını içerir. Denge anında konsantrasyonun [CO 2 ] P = olduğunu varsayalım. X mol/l. Sistemin denklemine göre oluşan hidrojenin mol sayısı da olacaktır. X mol/l. Aynı sayıda mol için (X mol/l) CO ve H2O oluşturmak için tüketilir X CO 2 ve H 2 molleri. Bu nedenle dört maddenin tamamının denge konsantrasyonları (mol/l):
[CO 2 ] P = [H 2 ] P = X;[CO]P = (3 – x); P =(2x).
Denge sabitini bilerek değeri buluruz X, ve ardından tüm maddelerin başlangıç konsantrasyonları:
![]() ; x 2 =6-2x-3x + x 2; 5x = 6, l = 1,2 mol/l.
; x 2 =6-2x-3x + x 2; 5x = 6, l = 1,2 mol/l.
Kimyasal denge, tersinir bir kimyasal reaksiyon durumudur.
aA+ B B= C C+ D D,
reaksiyon karışımındaki reaktanların konsantrasyonunda zamanla herhangi bir değişiklik olmaz. Kimyasal denge durumu karakterize edilir kimyasal denge sabiti:
Nerede C ben– bileşenlerin konsantrasyonu denge mükemmel karışım.
Denge sabiti aynı zamanda denge mol kesirleri cinsinden de ifade edilebilir. X ben bileşenler:
Gaz fazında meydana gelen reaksiyonlar için denge sabitini denge kısmi basınçları cinsinden ifade etmek uygundur. P ben bileşenler:
İdeal gazlar için P ben = C ve RT Ve P ben = X ve P, Nerede P toplam basınçtır, dolayısıyla KP, K C Ve K X aşağıdaki ilişkiyle ilişkilidir:
K P = K C (RT) c+d–a–b = K X P c+d–a–b. (9.4)
Denge sabiti şununla ilgilidir: rG o kimyasal reaksiyon:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
Değiştirmek rG veya r F Belirli (denge olması şart değil) kısmi basınçlarda bir kimyasal reaksiyonda P ben veya konsantrasyonlar C ben bileşenler denklem kullanılarak hesaplanabilir kimyasal reaksiyon izotermleri (van't Hoff izotermleri):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
Buna göre Le Chatelier'in ilkesi Dengede olan bir sisteme dışarıdan bir etki uygulanırsa denge, dış etkinin etkisini azaltacak şekilde kayar. Böylece basınçtaki bir artış dengeyi gaz moleküllerinin sayısındaki bir azalmaya doğru kaydırır. Bir denge karışımına herhangi bir reaksiyon bileşeninin eklenmesi, dengeyi bu bileşenin miktarındaki bir azalmaya doğru kaydırır. Sıcaklıktaki bir artış (veya azalma), dengeyi, ısının emilmesi (serbest bırakılması) ile meydana gelen bir reaksiyona doğru kaydırır.
Denge sabitinin sıcaklığa niceliksel bağımlılığı aşağıdaki denklemle tanımlanır: kimyasal reaksiyon izobarları (van't Hoff izobarları)
![]() (9.9)
(9.9)
Ve bir kimyasal reaksiyonun izokorları (van't Hoff izokorları)
![]() . (9.10)
. (9.10)
Denklemin (9.9) aşağıdaki varsayım altında entegre edilmesi: sağ nem reaksiyon sıcaklığa bağlı değildir (bu, dar sıcaklık aralıklarında doğrudur), şunu verir:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
Nerede C - entegrasyon sabiti. Böylece bağımlılık ln k 1'den P /T doğrusal olmalı ve düz çizginin eğimi – sağ nem/R.
Entegrasyon k 1 , k 2 ve T 1, T 2 verir:
 (9.13)
(9.13)
 (9.14)
(9.14)
Bu denklemi kullanarak, iki farklı sıcaklıktaki denge sabitlerini bilerek hesaplayabiliriz. sağ nem reaksiyonlar. Buna göre bilmek sağ nem Bir sıcaklıkta reaksiyon ve denge sabiti, başka bir sıcaklıkta denge sabitini hesaplayabilirsiniz.
ÖRNEKLER
CO(g) + 2H2 (g) = CH3OH(g)
500 K'da. f git o 500 K'de CO(g) ve CH3OH(g) için –155,41 kJ'ye eşittir. mol –1 ve –134,20 kJ. sırasıyla mol –1.
Çözüm. Gitmek reaksiyonlar:
r git= f git o(CH3OH) – f git o(CO) = –134,20 – (–155,41) = 21,21 kJ. mol –1 .
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
Örnek 9-2. Reaksiyon denge sabiti
eşittir k P = 1,64 10 –4, 400 o C'de. N2'nin %10'unun NH3'e dönüşmesi için eş molar N2 ve H2 karışımına hangi toplam basınç uygulanmalıdır? Gazlar ideal kabul edilir.
Çözüm. Bir mol N2'nin reaksiyona girmesine izin verin. Daha sonra
| N 2 (g) | + | 3H 2 (g) | = | 2NH3(g) | |
| Orijinal miktar | 1 | 1 | |||
| Denge miktarı | 1– | 1–3 | 2 (Toplam: 2–2) | ||
| Denge mol kesri: |
Buradan, k X = 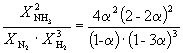 Ve K P = K X . P –2
=
Ve K P = K X . P –2
=  .
.
Ortaya çıkan formülde = 0,1 yerine koyarsak, şunu elde ederiz:
1.64 10 –4 =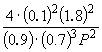 , Neresi P= 51,2 atmosfer.
, Neresi P= 51,2 atmosfer.
Örnek 9-3. Reaksiyon denge sabiti
CO(g) + 2H2 (g) = CH3OH(g)
500 K'da eşittir k P = 6,09 10 –3 . 1 mol CO, 2 mol H2 ve 1 mol atıl gazdan (N2) oluşan bir reaksiyon karışımı, 500 K'ye ve toplam 100 atm basınca ısıtılır. Denge karışımının bileşimini hesaplayın.
Çözüm. Bir mol CO'nun reaksiyona girmesine izin verin. Daha sonra
| Çark dişi) | + | 2H 2 (g) | = | CH3OH(g) | |
| Orijinal miktar: | 1 | 2 | 0 | ||
| Denge miktarı: | 1– | 2–2 | |||
| Denge karışımındaki toplam: | 3–2 mol bileşenler + 1 mol N2 = 4–2 mol | ||||
| Denge mol kesri | |||||
Buradan, k X =  Ve K P = K X . P-2 =
Ve K P = K X . P-2 = ![]() .
.
Böylece, 6,09 10 –3 = ![]() .
.
Bu denklemi çözerek = 0,732 elde ederiz. Buna göre denge karışımındaki maddelerin mol kesirleri şuna eşittir: = 0,288, = 0,106, = 0,212 ve = 0,394.
Örnek 9-4. Reaksiyon için
N2(g) + 3H2(g) = 2NH3(g)
298K'da k P = 6,0 10 5, a f H o(NH3) = –46,1 kJ. mol –1 . 500 K'deki denge sabitinin değerini tahmin edin.
Çözüm. Reaksiyonun standart molar entalpisi:
r H o= 2f H o(NH3) = –92,2 kJ. mol –1 .
Denklem (9.14)'e göre, 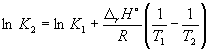 =
=
Ln (6,0 10 5) + ![]() = –1,73, buradan k 2 =
0.18.
= –1,73, buradan k 2 =
0.18.
Ekzotermik bir reaksiyonun denge sabitinin artan sıcaklıkla azaldığına dikkat edin; bu da Le Chatelier ilkesine karşılık gelir.
GÖREVLER
- Denge karışımında 1273 K'de ve toplam 30 atm basınçta
- 2000 o C sıcaklıkta ve toplam 1 atm basınçta suyun %2'si hidrojen ve oksijene ayrışır. Reaksiyonun denge sabitini hesaplayın
- Reaksiyon denge sabiti
- Reaksiyon denge sabiti
- 1,79 · 10 –2 mol I2 içeren 3 litrelik bir kap 973 K'ye ısıtıldı. Denge durumunda kaptaki basıncın 0,49 atm olduğu ortaya çıktı. Gazların ideal olduğunu varsayarak reaksiyon için 973 K'deki denge sabitini hesaplayın.
- Reaksiyon için
- Reaksiyon için
- 0,341 mol PCl5 ve 0,233 mol N2 içeren 1 litrelik bir kap 250 o C'ye ısıtıldı. Denge durumunda kaptaki toplam basıncın 29,33 atm olduğu ortaya çıktı. Tüm gazların ideal olduğunu varsayarak kapta meydana gelen reaksiyon için 250 o C'deki denge sabitini hesaplayınız.
- Reaksiyon denge sabiti
- 25 o C'de f git o(NH3) = –16,5 kJ. mol –1 . Hesaplamak rG sırasıyla 3 atm, 1 atm ve 4 atm'ye eşit N2, H2 ve NH3 kısmi basınçlarında NH3 oluşumunun reaksiyonları. Bu koşullar altında reaksiyon kendiliğinden hangi yönde ilerleyecektir?
- Egzotermik reaksiyon
- Borneolün (C10H17OH) izoborneole izomerizasyonunun gaz fazı reaksiyonunun denge sabiti, 503 K'de 0,106'dır. 7,5 g borneol ve 14,0 g izoborneolden oluşan bir karışım, 5 litrelik bir kaba yerleştirildi ve saklandı. Denge sağlanana kadar 503 K'de. Denge karışımındaki borneol ve izoborneolün mol kesirlerini ve kütlelerini hesaplayın.
- Reaksiyonda denge
- 400 o C'de hacimce %10 NH3 içeren bir denge karışımı elde etmek için 3 kısım H2 ve 1 kısım N2'den oluşan bir karışıma uygulanması gereken toplam basıncı hesaplayın. Reaksiyon için denge sabiti
- 250 o C'de ve toplam 1 atm basınçta PCl5 reaksiyonla %80 oranında ayrışır
- Reaksiyon için 2000 o C'de
- Denge sabitinin olduğu reaksiyonun standart entalpisini hesaplayın
Sıcaklık 298 K'den 308 K'ye değiştiğinde a) 2 kat artar, b) 2 kat azalır. - 2C 3 H 6 (g) = C 2 H 4 (g) + C 4 H 8 (g) reaksiyonunun denge sabitinin 300 K ile 600 K arasındaki sıcaklığa bağımlılığı denklem ile açıklanmaktadır.
C02 (g) + C(tv) = 2CO(g)
%17 (hacimce) CO2 içerir. Toplam 20 atm basınçta gazın içinde yüzde kaç CO 2 bulunacaktır? Gaz hangi basınçta %25 CO2 içerecektir?
Bu koşullar altında H 2 O (g) = H 2 (g) + 1/2O 2 (g).
CO(g) + H20(g) = CO2 (g) + H2 (g)
500 o C'de eşittir Kp= 5,5. 1 mol CO ve 5 mol H20'dan oluşan bir karışım bu sıcaklığa kadar ısıtıldı. Denge karışımındaki H 2 O'nun mol kesrini hesaplayın.
N 2 Ö 4 (g) = 2NO 2 (g)
25 o C'de eşittir Kp= 0,143. Bu sıcaklıkta içine 1 g N2O4 konulan 1 litre hacimli bir kapta oluşacak basıncı hesaplayınız.
ben2(g) = 2I(g).
250 o C'de rG o = –2508 J mol –1. Hangi toplam basınçta 250 o C'de PCl5'in PCl3 ve Cl2'ye dönüşüm derecesi %30 olacaktır?
2HI(g) = H2(g) + I2(g)
denge sabiti k 698,6 K'de P = 1,83 10 –2. Üç litrelik bir kapta 10 g I2 ve 0,2 g H2 bu sıcaklığa ısıtıldığında kaç gram HI oluşur? H 2, I 2 ve HI'nın kısmi basınçları nelerdir?
PCl5 (g) = PCl3 (g) + Cl2 (g)
CO(g) + 2H2 (g) = CH3OH(g)
500 K'da eşittir k P = 6,09 10 –3 . CO ve H2 1:2 oranında alındığında %90 verimle metanol üretmek için gereken toplam basıncı hesaplayın.
CO(g) + 2H2 (g) = CH3OH(g)
500 K ve 10 barda dengededir. Gazlar ideal ise aşağıdaki faktörler metanol verimini nasıl etkileyecektir: a) artış T; b) terfi P; c) atıl gazın eklenmesi V= sabit; d) atıl gazın eklenmesi P= sabit; e) H2 eklenmesi P= yapı?
2NOCl(g) = 2NO(g) + Cl2(g)
NOCl'nin kısmi basıncı 0,64 bar olduğunda (başlangıçta yalnızca NOCl mevcuttu), 227 o C'ye ve toplam basınç 1,0 bar'a ayarlandı. Hesaplamak r git tepki için. Hangi toplam basınçta Cl2'nin kısmi basıncı 0,10 bar'a eşit olacaktır?
N2(g) + 3H2(g) = 2NH3(g)
400 o C'de eşittir k = 1.60 10 –4 .
PCl5 (g) = PCl3 (g) + Cl2 (g).
Nitrojen kısmi basıncı 0,9 atm olacak şekilde sisteme N2 eklenirse PCl5'in ayrışma derecesi ne olacaktır? Toplam basınç 1 atm'de tutulur.
N 2 (g) + Ö 2 (g) = 2NO (g)
K p = 2,5 10 –3 . Toplam 1 bar basınçta N2, O2, NO ve inert gazdan oluşan bir denge karışımı, %80 (hacimce) N2 ve %16 O2 içerir. Hacimce yüzde kaç HAYIR'dır? İnert bir gazın kısmi basıncı nedir?
içinde k = –1.04 –1088 /T +1.51 10 5 /T 2 .
Kimyasal durum denge- bu, sürecin stokiyometrisi dikkate alınarak, ürünlerin ve başlangıç maddelerinin kimyasal potansiyelinin birbirine eşit olduğu bir durumdur.
İki koşulun karşılanması durumunda kimyasal dengeden bahsedebiliriz:
İleri ve geri reaksiyonların hızları eşittir.
Denge, dış bir etki uygulandığında ve daha sonra bu etki ortadan kaldırıldığında sistem orijinal durumuna geri döndüğünde var olur.
11. Kitlesel eylem yasası.
Sabit sıcaklıkta, bir kimyasal reaksiyonun hızı, reaksiyon denklemindeki stokiyometrik katsayılara eşit güçlerde alınan, reaksiyona giren maddelerin konsantrasyonlarının çarpımı ile doğru orantılıdır.
Örneğin amonyak sentezi reaksiyonu için:
N2 + 3H2 = 2NH3
kitlesel eylem yasası şu şekildedir:
ks = 2 / 3
12. Homojen bir sistemde denge sabiti. Denge sabitini ifade etme yolları.
denge sabiti stokiyometrik katsayılara karşılık gelen güçlerde alınan, son ve ilk reaksiyon katılımcılarının denge konsantrasyonlarının çarpımlarının oranına eşit sabit bir değerdir
Homojen Bir fazda meydana gelen reaksiyonlara gaz karışımında, sıvıda veya bazen katı çözeltide denir.
Denge Sabitini İfade Etmenin Yolları
Reaksiyona dahil olan maddelerin konsantrasyonları molar molarite birimleri cinsinden ifade edilirse; mol/l cinsinden genellikle Kc olarak gösterilir
Homojen bir gaz reaksiyonu için denge sabitini maddelerin kısmi basınçları cinsinden ifade etmek daha uygundur:

Bazen denge sabitini kısmi basınçlar ve konsantrasyonlar cinsinden değil, madde miktarları cinsinden ifade etmek uygun olur:  veya karşılık gelen mol kesirleri aracılığıyla:
veya karşılık gelen mol kesirleri aracılığıyla: 
Genel durumda denge sabitleri Kc, Kp, Kn ve KN farklıdır.
13. Le Chatelier-Brown ilkesi .
Dengede olan bir sisteme dışarıdan bir etki uygulandığında denge, dış etkiyi zayıflatacak yöne kayar.
14. Van't Hoff izobar denklemi.
Bu ifade T'nin denge ve denge sabiti üzerindeki etkisini niteliksel olarak değerlendirmemize olanak tanır.
15.Aşama.
Aşama denir - heterojen bir sistemin, içindeki tüm özelliklerin sürekli olarak ve aniden geçerken değişebildiği gerçek bir arayüze sahip homojen bir parçası.
16.Bileşenler ve bileşenler.
Bileşen denir– Sistemlerin durumunu açıklamaya yeterli olan minimum bileşen sayısı.
Bileşen maddelerarandı - Bir sistemin parçası olan, geleneksel ilaç yöntemleri kullanılarak izole edilebilen ve istenildiği sürece sistem dışında bulunabilen maddelerdir.
17. Gibbs faz kuralı .
Dış etkenler arasında yalnızca sıcaklık ve basınçtan etkilenen bir denge termodinamik sisteminin serbestlik derecesi sayısı, bağımsız bileşenlerin sayısına eşittir. S=K-F+N(harici parametrelerin sayısı)
Faz kuralı, serbestlik derecesi sayısının sistemin bileşen sayısıyla arttığını ve sistemin faz sayısıyla azaldığını gösterir.
18. Sistemde faz dengesi koşulları.
Heterojen bir sistemde fazlar arasında aşağıdaki denge türleri mevcutsa faz dengesi vardır:
Termal (sıcaklık eşitliği)
Mekanik (basınç eşitliği)
Kimyasal her bileşen için
19.Clausius-Clausius denklemi
Nerede, - Δ V- Bir maddenin birinci fazdan ikinci faza geçişi sırasında hacmindeki değişiklik, T – geçiş sıcaklığı, Δ H– 1 mol maddenin bir fazdan diğerine geçişi sırasında maddenin entropi ve entalpisindeki değişim
2 parametre değiştiğinde bir faz geçişi sırasında sıcaklığın veya basıncın nasıl değişeceğini tahmin etmenizi sağlar.
20. su durumu diyagramı
Sistemin durumunu karakterize eden miktarlar ile sistemdeki faz dönüşümleri arasındaki ilişki - katıdan sıvıya, sıvıdan gaza geçiş
21. Doğru çözümler. Bir çözeltinin konsantrasyonunu ifade etme yolları. Bir maddenin molar ve kütle fraksiyonunun ve bir maddenin çözelti içindeki molar konsantrasyonunun hesaplanması.

Doğru çözüm- Bu, çözünen maddenin parçacık boyutlarının son derece küçük olduğu ve çözücü parçacıklarının boyutuyla karşılaştırılabilir olduğu bir çözelti türüdür.
Çözümler var gazlı(gaz karışımları), sıvı Ve zor. Gaz halindeki çözelti havadır. Deniz suyu, sudaki tuzların bir karışımıdır - sıvı bir çözelti. Katı çözümler – metal alaşımları. Çözeltiler bir çözücü ve bir çözünen(ler)den oluşur.
Çözüm denir iki veya daha fazla bileşenden oluşan katı veya sıvı homojen bir sistem.
Bir çözücü dikkate alınır– bir çözeltinin veya hacim veya kütle bakımından daha büyük bir maddenin toplanma durumunu belirleyen bir madde.
Çözeltilerin konsantrasyonunu ifade etme yöntemleri.
Çözüm konsantrasyonu bir çözeltinin veya çözücünün belirli bir miktarı, kütlesi veya hacmindeki çözünen maddenin kütlesi veya miktarıdır.
1) Kütle fraksiyonu ( kablosuz ) 100 gram çözeltide bulunan çözünen maddenin kütlesidir.
2) Mol fraksiyonu (mol) – X Ben – 1 mol çözeltide bulunan bileşenin mol sayısı.
3) Molal konsantrasyonu (molalite) mi – 1 kg solventte bulunan çözünen maddenin mol sayısı [mol/kg].
4) Molar konsantrasyon İLE Ben – 1 litre veya 1 dm3 çözeltide bulunan çözünmüş maddenin mol sayısı [mol/l].
