Kimyasal reaksiyon denklemlerindeki katsayıları düzenleyin. Kimyasal reaksiyon denklemlerinde katsayıların düzenlenmesi konusunda kimya dersi" (8. sınıf)
Redoks reaksiyonlarının denklemlerindeki katsayıları belirlemek için çeşitli yöntemler vardır. Tam OVR denkleminin derlenmesinin aşağıdaki sırayla gerçekleştirildiği elektronik denge yöntemini kullanıyoruz:
1. Reaksiyona giren maddeleri ve reaksiyondan kaynaklanan maddeleri gösteren bir reaksiyon diyagramı çizin, örneğin:
2. Atomların oksidasyon durumunu belirleyin ve oksidasyon durumu değişen elementleri not ederek işaretini ve değerini elementlerin sembollerinin üzerine yazın:
3. Yükseltgenme ve indirgeme reaksiyonları için elektronik denklemleri yazın, indirgeyici madde tarafından verilen ve yükseltgen madde tarafından kabul edilen elektronların sayısını belirleyin ve ardından bunları uygun katsayılarla çarparak eşitleyin:
4. Elektronik teraziye karşılık gelen elde edilen katsayılar ana denkleme aktarılır:
5. Oksidasyon durumunu değiştirmeyen atom ve iyonların sayısını eşitleyin (sırayla: metaller, ametaller, hidrojen):
6. Reaksiyon denkleminin sol ve sağ taraflarındaki oksijen atomu sayısına göre katsayı seçiminin doğruluğunu kontrol edin - bunlar eşit olmalıdır (bu denklemde 24 = 18 + 2 + 4, 24 = 24).
Daha karmaşık bir örneğe bakalım:
Moleküllerdeki atomların oksidasyon durumlarını belirleyelim:
Yükseltgenme ve indirgeme reaksiyonları için elektronik denklemler oluşturalım ve verilen ve kabul edilen elektronların sayısını eşitleyelim:
Katsayıları ana denkleme aktaralım:
Oksidasyon durumunu değiştirmeyen atomların sayısını eşitleyelim:
Denklemin sağ ve sol tarafındaki oksijen atomlarının sayısını sayarak katsayıların doğru seçildiğinden emin olacağız.
En önemli oksitleyici ve indirgeyici maddeler
Elementlerin redoks özellikleri, atomların elektron kabuğunun yapısına bağlıdır ve Mendeleev'in periyodik tablosundaki konumlarına göre belirlenir.
Dış enerji seviyesinde 1-3 elektronu bulunan metaller kolaylıkla bunlardan vazgeçer ve sadece indirgeyici özellikler gösterirler. Ametaller (IV-VII gruplarının elemanları) hem elektron verebilir hem de kabul edebilir, dolayısıyla hem indirgeyici hem de oksitleyici özellikler sergileyebilirler. Bir elementin atom numarasının arttığı dönemlerde basit maddelerin indirgeyici özellikleri zayıflar, oksitleyici özellikleri artar. Seri numarası artan gruplarda indirgeyici özellikler artar, oksitleyici özellikler zayıflar. Böylece, Basit maddelerden en iyi indirgeyici maddeler alkali metaller, alüminyum, hidrojen, karbondur; en iyi oksitleyici maddeler halojenler ve oksijendir.
Karmaşık maddelerin redoks özellikleri, onları oluşturan atomların oksidasyon derecesine bağlıdır. En düşük oksidasyon durumuna sahip atomları içeren maddeler indirgeyici özellikler sergiler. En önemli indirgeyici ajanlar karbon monoksittir.  , hidrojen sülfit
, hidrojen sülfit  , demir(II) sülfat
, demir(II) sülfat  .En yüksek oksidasyon durumuna sahip atomları içeren maddeler oksitleyici özellikler sergiler. En önemli oksitleyici ajanlar potasyum permanganattır.
.En yüksek oksidasyon durumuna sahip atomları içeren maddeler oksitleyici özellikler sergiler. En önemli oksitleyici ajanlar potasyum permanganattır.  , potasyum dikromat
, potasyum dikromat  , hidrojen peroksit
, hidrojen peroksit  , Nitrik asit
, Nitrik asit  , konsantre sülfürik asit
, konsantre sülfürik asit  .
.
Ara oksidasyon durumlarına sahip atomlar içeren maddeler, oksitleyici veya indirgeyici maddeler olarak davranabilir etkileşime girdikleri maddelerin özelliklerine ve reaksiyon koşullarına bağlıdır. Yani tepki olarak  sülfürik asit indirgeyici özellikler sergiler:
sülfürik asit indirgeyici özellikler sergiler:
ve hidrojen sülfür ile etkileşime girdiğinde oksitleyici bir maddedir:

Ek olarak, bu tür maddeler için, aynı elementin atomlarının oksidasyon durumunda eşzamanlı bir artış ve azalma ile meydana gelen kendi kendine oksidasyon-kendini azaltma reaksiyonları mümkündür, örneğin:
Birçok oksitleyici ve indirgeyici maddenin gücü ortamın pH'ına bağlıdır. Örneğin, 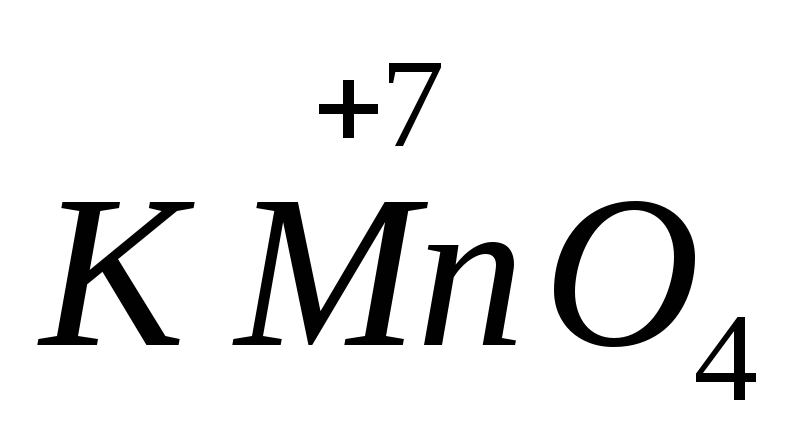 alkali bir ortamda indirgenir
alkali bir ortamda indirgenir  , tarafsız olarak
, tarafsız olarak  sülfürik asit varlığında - kadar
sülfürik asit varlığında - kadar  .
.
En basit reaksiyon denklemi:
Fe + S => FeS
Reaksiyon denklemini sadece yazabilmeniz değil, aynı zamanda okuyabilmeniz de gerekir. Bu denklem en basit haliyle şu şekildedir: Bir demir molekülü bir kükürt molekülüyle etkileşime girer ve sonuçta bir demir sülfür molekülü oluşur.
Bir reaksiyon denklemi yazarken en zor şey reaksiyon ürünleri için formüller oluşturmaktır; oluşan maddeler. Burada tek bir kural vardır: Moleküllerin formülleri, kendilerini oluşturan elementlerin değerlerine sıkı sıkıya göre oluşturulur.
Ek olarak, reaksiyon denklemlerini hazırlarken, maddelerin kütlesinin korunumu yasasını hatırlamak gerekir: başlangıç maddelerinin moleküllerinin tüm atomları, reaksiyon ürünlerinin moleküllerine dahil edilmelidir. Tek bir atomun kaybolmaması veya beklenmedik bir şekilde ortaya çıkmaması gerekir. Bu nedenle bazen reaksiyon denklemindeki tüm formülleri yazdıktan sonra denklemin her bir kısmındaki atom sayısını eşitlemeniz, katsayıları ayarlamanız gerekir. İşte bir örnek:
C + O2 => CO2Burada her element denklemin hem sağ hem de sol tarafında aynı sayıda atoma sahiptir. Denklem hazır.
Cu+O 2 => CuO
Ve burada denklemin sol tarafında sağ tarafına göre daha fazla oksijen atomu var. Bu kadar çok bakır oksit molekülü elde etmek gerekiyor
CuO , böylece aynı sayıda oksijen atomu içerirler, yani 2. Bu nedenle formülCuO katsayı 2'yi ayarla:Cu+O2 => 2 CuO
Artık bakır atomlarının sayısı aynı değil. Denklemin sol tarafında bakır işaretinin önüne 2 katsayısını koyarız:
2 Cu + O2 => 2 CuO
Denklemin sol ve sağ taraflarında her bir elementin eşit sayıda atomunun olup olmadığını sayın. Cevabınız evet ise reaksiyon denklemi doğrudur.
Bir örnek daha: Al+O 2 = Al 2 Ö 3
Ve burada reaksiyondan önce ve sonra her elementin farklı sayıda atomu var. Gazla - oksijen molekülleriyle tesviye etmeye başlıyoruz:
1 kaldı 2 oksijen atomu ve sağdaki 3. Bu iki sayının en küçük ortak katını arıyoruz. Bu en küçük sayı hem 2'ye hem de 3'e, yani 6'ya bölünebilir. Oksijen ve alüminyum oksit formüllerinden önceAl 2 Ö 3 Katsayıları öyle ayarladık ki toplam sayısı Bu moleküllerde 6 oksijen atomu vardı:
Al+ 3 Ç 2= 2 Al 2 O 3
2) Alüminyum atomlarının sayısını sayıyoruz: Solda 1 atom, sağda ise iki molekülde 2 atom var, yani. 4. Denklemin sol tarafındaki alüminyum işaretinin önüne 4 katsayısını koyarız:
4Al + 3O 2 => 2 Al2O3
3) Bir kez daha reaksiyondan önceki ve sonraki tüm atomları sayıyoruz: her biri 4 alüminyum atomu ve 6 oksijen atomu.
Her şey yolunda, reaksiyon denklemi doğru. Ve eğer reaksiyon ısıtıldığında meydana gelirse, okun üzerine ek bir işaret yerleştirilir. T.
Kimyasal reaksiyonun denklemi, kimyasal formüller ve katsayılar kullanılarak kimyasal reaksiyonun ilerlemesinin kaydedilmesidir.
1. Bir reaksiyon diyagramı çizelim:
Dersin Hedefleri.Eğitici.Öğrencileri yeni sınıflandırmayla tanıştırın kimyasal reaksiyonlar redoks reaksiyonları (ORR) ile elementlerin oksidasyon durumlarındaki değişikliklere dayanarak; Öğrencilere elektronik denge yöntemini kullanarak katsayıları düzenlemeyi öğretin.
Gelişimsel. Geliştirmeye devam edin mantıksal düşünme, analiz etme ve karşılaştırma becerisi, konuya ilgi geliştirme.
Eğitici.Öğrencilerin bilimsel dünya görüşünü oluşturmak; çalışma becerilerini geliştirmek.
Yöntemler ve metodolojik teknikler. Hikaye, konuşma, görsel araçların gösterilmesi, bağımsız işöğrenciler.
Ekipman ve reaktifler. Rodos Heykeli'nin görüntüsüyle çoğaltma, elektronik denge yöntemini kullanarak katsayıları düzenlemek için algoritma, tipik oksitleyici ve indirgeyici ajanların tablosu, bulmaca; Fe (çivi), NaOH, CuSO4 çözeltileri.
DERSLER SIRASINDA
Giriş bölümü
(motivasyon ve hedef belirleme)
Öğretmen. 3. yüzyılda. M.Ö. Rodos adasında, Helios'un (Yunan Güneş tanrısı) devasa bir heykeli şeklinde bir anıt inşa edildi. Dünyanın harikalarından biri olan Rodos Heykeli'nin görkemli tasarımı ve mükemmel icrası, onu gören herkesi hayrete düşürdü.
Heykelin tam olarak neye benzediğini bilmiyoruz ancak bronzdan yapıldığını ve yaklaşık 33 m yüksekliğe ulaştığını biliyoruz. Heykel, heykeltıraş Haret tarafından yapılmış ve yapımı 12 yıl sürmüştür.
Bronz kabuk demir bir çerçeveye tutturuldu. İçi boş heykel alttan yapılmaya başlandı ve büyüdükçe daha sağlam olması için içi taşlarla dolduruldu. Tamamlanmasından yaklaşık 50 yıl sonra Colossus çöktü. Deprem sırasında diz hizasında kırıldı.
Bilim insanları bu mucizenin kırılganlığının gerçek nedeninin metal korozyonu olduğuna inanıyor. Ve korozyon süreci redoks reaksiyonlarına dayanmaktadır.
Bugünkü dersimizde redoks reaksiyonlarını öğreneceksiniz; “İndirgeyici madde” ve “oksitleyici madde” kavramlarını, indirgeme ve oksidasyon süreçlerini öğrenmek; Katsayıları redoks reaksiyonlarının denklemlerine yerleştirmeyi öğrenin. Dersin tarihini ve konusunu çalışma kitaplarınıza yazın.
Yeni materyal öğrenme
Öğretmen iki gösteri deneyi gerçekleştirir: bakır(II) sülfatın alkali ile etkileşimi ve aynı tuzun demir ile etkileşimi.
Öğretmen. Gerçekleştirilen reaksiyonların moleküler denklemlerini yazınız. Her denklemde, başlangıç maddelerinin ve reaksiyon ürünlerinin formüllerindeki elementlerin oksidasyon durumlarını düzenleyin.
Öğrenci tahtaya reaksiyon denklemlerini yazar ve oksidasyon durumlarını atar:
Öğretmen. Bu reaksiyonlarda elementlerin oksidasyon durumları değişti mi?
Öğrenci. İlk denklemde elementlerin oksidasyon durumları değişmedi, ancak ikincisinde bakır ve demir için değişti..
Öğretmen. İkinci reaksiyon redoks reaksiyonudur. Redoks reaksiyonlarını tanımlamaya çalışın.
Öğrenci. Reaktanları ve reaksiyon ürünlerini oluşturan elementlerin oksidasyon durumlarında değişikliklere neden olan reaksiyonlara redoks reaksiyonları denir.
Öğrenciler öğretmenin talimatıyla redoks reaksiyonlarının tanımını not defterlerine yazarlar.
Öğretmen. Redoks reaksiyonu sonucunda ne oldu? Reaksiyondan önce demirin oksidasyon durumu 0'dı, reaksiyondan sonra +2 oldu. Gördüğümüz gibi oksidasyon durumu arttı, bu nedenle demir 2 elektron verir.
Bakırın reaksiyondan önce oksidasyon durumu +2, reaksiyondan sonra ise 0'dır. Görüldüğü gibi oksidasyon durumu azalmıştır. Bu nedenle bakır 2 elektron kabul eder.
Demir elektron verir, indirgeyici bir maddedir ve elektron aktarma işlemine oksidasyon denir.
Bakır elektronları kabul eder, oksitleyici bir maddedir ve elektron ekleme işlemine indirgeme denir.
Bu süreçlerin diyagramlarını yazalım:
Bu nedenle, “indirgeyici madde” ve “oksitleyici madde” kavramlarının tanımını verin.
Öğrenci. Elektron veren atom, molekül veya iyonlara indirgeyici maddeler denir.
Elektron kazanan atom, molekül veya iyonlara oksitleyici maddeler denir.
Öğretmen. İndirgeme ve oksidasyon süreçlerini nasıl tanımlayabiliriz?
Öğrenci. İndirgeme, bir atomun, molekülün veya iyonun elektron kazandığı süreçtir.
Oksidasyon, elektronların bir atom, molekül veya iyon tarafından aktarılması işlemidir.
Öğrenciler dikteden elde edilen tanımları bir deftere yazıp çizerler.
Hatırlamak!
Elektronları bağışlayın ve oksitleyin.
Elektronları alın - kurtarın.
Öğretmen. Oksidasyona her zaman indirgeme eşlik eder ve bunun tersi de, indirgeme her zaman oksidasyonla ilişkilidir. İndirgeyici maddenin verdiği elektronların sayısı, oksitleyici maddenin kazandığı elektronların sayısına eşittir.
Redoks reaksiyonlarının denklemlerindeki katsayıları seçmek için iki yöntem kullanılır - elektronik denge ve elektron-iyon dengesi (yarı reaksiyon yöntemi).
Sadece elektronik denge yöntemini ele alacağız. Bunu yapmak için, elektronik denge yöntemini (bir Whatman kağıdı üzerinde tasarlanmış) kullanarak katsayıları düzenlemek için bir algoritma kullanıyoruz.
ÖRNEK Elektronik denge yöntemini kullanarak bu reaksiyon şemasındaki katsayıları düzenleyin, oksitleyici maddeyi ve indirgeyici maddeyi belirleyin, oksidasyon ve indirgeme işlemlerini belirtin:
Fe2O3 + CO Fe + CO2.
Elektronik denge yöntemini kullanarak katsayıları düzenlemek için algoritmayı kullanacağız.
3. Oksidasyon durumlarını değiştiren elementleri yazalım:
4. Verilen ve alınan elektronların sayısını belirleyen elektronik denklemler oluşturalım:
5. Verilen ve alınan elektronların sayısı aynı olmalıdır çünkü Ne başlangıç malzemeleri ne de reaksiyon ürünleri yüklenmez. Verilen ve alınan elektronların sayısını, en küçük ortak katı (LCM) ve ek faktörleri seçerek eşitliyoruz:
6. Ortaya çıkan çarpanlar katsayılardır. Katsayıları reaksiyon şemasına aktaralım:
Fe2O3 + 3CO = 2Fe + 3CO2.
Birçok reaksiyonda oksitleyici veya indirgeyici maddeler olan maddelere tipik denir.
Bir parça Whatman kağıdı üzerine yapılmış bir tablo asılır.
Öğretmen. Redoks reaksiyonları çok yaygındır. Bunlar yalnızca korozyon süreçleriyle değil aynı zamanda canlı bir organizmada meydana gelen fermantasyon, çürüme, fotosentez ve metabolik süreçlerle de ilişkilidir. Yakıtın yanması sırasında gözlemlenebilirler.
Kimyasal bir denklem nasıl dengelenir: kurallar ve algoritma
Redoks süreçleri doğadaki maddelerin döngülerine eşlik eder.
Atmosferde her gün yaklaşık 2 milyon ton nitrik asit oluştuğunu biliyor muydunuz?
Yılda 700 milyon ton nitrik asit, yağmurla birlikte zayıf bir çözelti halinde yere düşüyor (insan yılda sadece 30 milyon ton nitrik asit üretiyor).
Atmosferde neler oluyor?
Havanın hacminin %78'i nitrojen, %21'i oksijen ve %1'i diğer gazlardan oluşur. Yıldırım deşarjlarının etkisi altında ve Dünya'da saniyede ortalama 100 şimşek çakması meydana geldiğinde, nitrojen molekülleri oksijen molekülleri ile etkileşime girerek nitrik oksit (II) oluşturur:
Nitrik oksit(II), atmosferik oksijen tarafından kolayca nitrik okside(IV) oksitlenir:
Ortaya çıkan nitrojen oksit (IV), oksijen varlığında atmosferik nem ile reaksiyona girerek nitrik asite dönüşür:
NO2 + H2O + O2 HNO3.
Bu reaksiyonların tümü redokstur.
Egzersiz yapmak . Elektronik denge yöntemini kullanarak verilen reaksiyon şemalarındaki katsayıları düzenleyin, oksitleyici maddeyi, indirgeyici maddeyi, oksidasyon ve indirgeme işlemlerini belirtin.
Çözüm
1. Elementlerin oksidasyon durumlarını belirleyelim:
2. Yükseltgenme durumları değişen elementlerin sembollerini vurgulayalım:
3. Yükseltgenme durumları değişen elementleri yazalım:
4. Elektronik denklemler oluşturalım (verilen ve alınan elektronların sayısını belirleyelim):
5. Verilen ve alınan elektron sayısı aynıdır.
6. Elektronik devrelerdeki katsayıları reaksiyon diyagramına aktaralım:
Daha sonra öğrencilerden elektronik denge yöntemini kullanarak katsayıları bağımsız olarak düzenlemeleri, oksitleyici maddeyi, indirgeyici maddeyi belirlemeleri ve doğada meydana gelen diğer işlemlerde oksidasyon ve indirgeme süreçlerini belirtmeleri istenir.
Diğer iki reaksiyon denklemi (katsayılı) şu şekildedir:
Görevlerin doğruluğu tepegöz kullanılarak kontrol edilir.
Son bölüm
Öğretmen öğrencilerden okudukları materyale göre bir bulmaca çözmelerini ister. Çalışmanın sonucu doğrulama için gönderilir.
Çözdükten sonra bulmaca KMnO4, K2Cr2O7, O3 maddelerinin güçlü olduğunu öğreneceksiniz... (dikey (2)).
Yatay olarak:
1. Diyagram hangi süreci yansıtıyor:
3. Tepki
N2 (g.) + 3H2 (g.) 2NH3 (g.) + Q
redokstur, tersinirdir, homojendir, ....
4. ... karbon(II) tipik bir indirgeyici maddedir.
5. Diyagram hangi süreci yansıtıyor:
6. Redoks reaksiyonlarının denklemlerindeki katsayıları seçmek için elektronik... yöntemini kullanın.
7. Diyagrama göre alüminyum bir elektrondan vazgeçti.
8. Tepki olarak:
H2 + Cl2 = 2HCl
hidrojen H2 – ... .
9. Hangi tür reaksiyonlar her zaman yalnızca redokstur?
10. Basit maddelerin oksidasyon durumu….
11. Tepki olarak:
indirgen madde -….
Ev ödevi.
O.S. Gabrielyan'ın “Kimya-8” § 43, s. 178–179, ör. 1, 7 yazılı olarak. Görev (ev için). İlk tasarımcılar uzay gemileri ve denizaltılar bir sorunla karşı karşıya kaldılar: Gemide ve uzay istasyonlarında sabit bir hava bileşimi nasıl korunur? Fazla karbondioksitten kurtulup oksijeni yenilemek mi istiyorsunuz? Bir çözüm bulundu.
Potasyum süperoksit KO2 karbondioksitle reaksiyona girerek oksijen oluşturur:
Gördüğünüz gibi bu bir redoks reaksiyonudur. Bu reaksiyondaki oksijen hem oksitleyici hem de indirgeyici bir maddedir.
Bir uzay görevinde kargonun her gramı önemlidir. Uçuşun 10 gün sürmesi ve mürettebatın iki kişiden oluşması durumunda, uzay uçuşunda alınması gereken potasyum süperoksit miktarını hesaplayınız. Bir kişinin günde 1 kg karbondioksit soluduğu bilinmektedir.
(Cevap: 64,5 kg KO2. )
Ödev (artan zorluk seviyesi). Rodos Heykeli'nin yok olmasına yol açabilecek redoks reaksiyonlarının denklemlerini yazın. Bu dev heykelin, Ege Denizi'ndeki bir adada, günümüz Türkiye'sinin açıklarında, nemli Akdeniz havasının tuzlarla yüklü olduğu bir liman şehrinde durduğunu unutmayın. Bronzdan (bakır ve kalay alaşımı) yapılmış ve demir bir çerçeve üzerine monte edilmiştir.
Edebiyat
Gabrielyan O.S.. Kimya-8. M.: Bustard, 2002;
Gabrielyan O.S., Voskoboynikova N.P., Yashukova A.V.Öğretmenin el kitabı. 8. sınıf. M.: Bustard, 2002;
Cox R., Morris N.. Dünyanın yedi Harikası. Antik Dünya, Orta Çağ, bizim zamanımız. M.: BMM AO, 1997;
Küçük çocuk ansiklopedisi. Kimya. M.: Rusya Ansiklopedik Ortaklığı, 2001; Çocuklar için ansiklopedi "Avanta+". Kimya. T. 17. M.: Avanta+, 2001;
Khomchenko G.P., Sevastyanova K.I. Redoks reaksiyonları. M.: Eğitim, 1989.
S.P. Lebesheva,
8 numaralı ortaokulun kimya öğretmeni
(Baltiysk, Kaliningrad bölgesi)
Oran seçme kuralları:
- Reaksiyon şemasının bir kısmındaki bir elementin atom sayısı çift ve diğerinde tek ise, o zaman tek sayıda atom içeren formülün önüne 2 katsayısı ve ardından tüm sayıların sayısı konulmalıdır. atomların eşitlenmesi gerekir.
- katsayıların yerleştirilmesi bileşimdeki en karmaşık maddeyle başlamalı ve bunu aşağıdaki sırayla yapmalıdır:
önce metal atomlarının sayısını, ardından asit kalıntılarını (metal olmayan atomlar), ardından hidrojen atomlarını ve son olarak oksijen atomlarını eşitlemeniz gerekir.
— Denklemin sol ve sağ tarafındaki oksijen atomlarının sayısı aynı ise katsayılar doğru olarak belirlenir.
- bundan sonra denklemin bölümleri arasındaki ok eşittir işaretiyle değiştirilebilir.
— Kimyasal reaksiyon denklemindeki katsayıların ortak bölenleri olmamalıdır.
Örnek. Demir (III) hidroksit ile sülfürik asit arasındaki demir (III) sülfatı oluşturan kimyasal reaksiyon için bir denklem oluşturalım.
1. Bir reaksiyon diyagramı çizelim:
Fe(OH)3 + H2SO4 → Fe2(SO4)3 + H2O
2. Maddelerin formülleri için katsayıları seçelim. En karmaşık maddeyle başlamamız ve tüm şema boyunca sırasıyla metal atomlarını, sonra asit kalıntılarını, sonra hidrojeni ve son olarak oksijeni eşitlememiz gerektiğini biliyoruz. Bizim şemamızda en karmaşık madde Fe2(SO4)3'tür. İki demir atomu içerir ve Fe(OH)3 bir demir atomu içerir. Bu, Fe(OH)3 formülünden önce 2 katsayısını koymanız gerektiği anlamına gelir:
2Fe(OH)3 + H2SO4 → Fe2(SO4)3 + H2O
Şimdi SO4'ün asidik kalıntılarının sayısını eşitleyelim. Fe2(SO4)3 tuzu üç asidik SO4 kalıntısı içerir. Bu, H2SO4 formülünden önce sol tarafa 3 katsayısını koyduğumuz anlamına gelir:
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + H2O.
Şimdi hidrojen atomlarının sayısını eşitleyelim. Diyagramın sol tarafında demir hidroksitte 2Fe(OH)3 – 6 hidrojen atomu (2
· 3), sülfürik asit 3H2SO4'te ayrıca 6 hidrojen atomu vardır.
Katsayılar kimyasal denklemlere nasıl yerleştirilir?
Sol tarafta toplam 12 hidrojen atomu vardır. Bu, sağ tarafta H2O su formülünün önüne 6 katsayısını koyduğumuz anlamına gelir - ve şimdi sağ tarafta da 12 hidrojen atomu vardır:
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O.
Oksijen atomlarının sayısını eşitlemek için kalır. Ancak bu artık gerekli değil, çünkü diyagramın sol ve sağ kısımlarında zaten aynı sayıda oksijen atomu var (her kısımda 18). Bu, diyagramın tamamen yazıldığı anlamına gelir ve oku eşittir işaretiyle değiştirebiliriz:
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O.
Eğitim
Kimyasal denklemlerde katsayılar nasıl yerleştirilir? Kimyasal denklemler
Bugün katsayıların kimyasal denklemlere nasıl yerleştirileceğinden bahsedeceğiz. Bu soru sadece genel eğitim kurumlarının lise öğrencilerini değil, aynı zamanda karmaşık ve ilginç bilimin temel unsurlarıyla yeni tanışan çocukları da ilgilendiriyor. İlk aşamada kimyasal denklemlerin nasıl yazılacağını anlarsanız ileride problem çözmede sorun yaşamazsınız. En baştan çözelim.
Denklem nedir
Genellikle seçilen reaktifler arasında meydana gelen bir kimyasal reaksiyonun geleneksel bir kaydı olarak anlaşılır. Böyle bir işlem için endeksler, katsayılar ve formüller kullanılır.
Derleme algoritması
Kimyasal denklemler nasıl yazılır? Herhangi bir etkileşimin örnekleri, orijinal bağlantıların toplanmasıyla yazılabilir. Eşittir işareti, reaksiyona giren maddeler arasında etkileşimin meydana geldiğini gösterir. Daha sonra ürünlerin formülü valansa (oksidasyon durumuna) göre derlenir.
Konuyla ilgili video
Bir reaksiyon nasıl kaydedilir?
Örneğin, metanın özelliklerini doğrulayan kimyasal denklemler yazmanız gerekiyorsa aşağıdaki seçenekleri seçin:
- halojenasyon (eleman VIIA ile radikal etkileşim periyodik tablo D. I. Mendeleev);
- hava oksijeninde yanma.

İlk durumda başlangıç maddelerini sol tarafa, ortaya çıkan ürünleri ise sağ tarafa yazıyoruz. Her bir kimyasal elementin atom sayısını kontrol ettikten sonra devam eden sürecin son kaydını elde ederiz. Metan havadaki oksijende yandığında ekzotermik bir süreç meydana gelir ve bunun sonucunda karbon dioksit ve su buharı.
Kimyasal denklemlerdeki katsayıları doğru bir şekilde ayarlamak için maddelerin kütlesinin korunumu yasası kullanılır. Eşitleme işlemine karbon atomu sayısını belirleyerek başlıyoruz. Daha sonra hidrojen için hesaplamalar yapıyoruz ve ancak bundan sonra oksijen miktarını kontrol ediyoruz.
OVR
Karmaşık kimyasal denklemler elektron dengesi veya yarı reaksiyon yöntemi kullanılarak dengelenebilir. Aşağıdaki reaksiyon türlerinde katsayıları atamak için tasarlanmış bir dizi eylem sunuyoruz:

İlk olarak, bileşikteki her bir elementin oksidasyon durumlarının düzenlenmesi önemlidir. Bunları düzenlerken bazı kuralları dikkate almak gerekir:
- Basit bir madde için sıfırdır.
- İkili bir bileşikte toplamları 0'dır.
- Üç veya daha fazla elementten oluşan bir bileşikte, ilki pozitif bir değer sergiler, en dıştaki iyon ise - olumsuz anlam oksidasyon derecesi. Merkezi eleman, toplamın 0 olması gerektiği dikkate alınarak matematiksel olarak hesaplanır.
Daha sonra oksidasyon durumu değişen atomları veya iyonları seçin. Artı ve eksi işaretleri elektron sayısını (alınan, verilen) gösterir. Daha sonra aralarındaki en küçük kat belirlenir. NOC bu sayılara bölündüğünde sayılar elde edilir. Bu algoritma kimyasal denklemlerde katsayıların nasıl yerleştirileceği sorusunun cevabı olacaktır.
İlk örnek
Diyelim ki görev verildi: "Reaksiyondaki katsayıları düzenleyin, boşlukları doldurun, oksitleyici maddeyi ve indirgeyici maddeyi belirleyin." Bu tür örnekler, Birleşik Devlet Sınavı olarak kimyayı seçen okul mezunlarına sunulmaktadır.
KMnO4 + H2SO4 + KBr = MnSO4 + Br2 ++…+…

Geleceğin mühendislerine ve doktorlarına sunulan kimyasal denklemlere katsayıların nasıl yerleştirileceğini anlamaya çalışalım. Başlangıç malzemelerindeki ve mevcut ürünlerdeki elementlerin oksidasyon durumlarını düzenledikten sonra, manganez iyonunun oksitleyici bir madde olarak hareket ettiğini ve bromür iyonunun indirgeyici özellikler sergilediğini bulduk.
Kaçırılan maddelerin redoks sürecine katılmadığı sonucuna vardık. Eksik ürünlerden biri su, ikincisi ise potasyum sülfat olacaktır. Elektronik terazinin derlenmesinden sonra son aşama denklemdeki katsayıların ayarlanması olacaktır.
İkinci örnek
Katsayıların redoks tipi kimyasal denklemlere nasıl yerleştirileceğini anlamak için başka bir örnek verelim.
Diyelim ki bize aşağıdaki diyagram verildi:
P + HNO3 = NO2 ++…+…
Tanımı gereği basit bir madde olan fosfor, indirgeyici özellikler sergileyerek oksidasyon durumunu +5'e yükseltir. Bu nedenle eksik maddelerden biri fosforik asit H3PO4 olacaktır. ORR, nitrojen olacak bir indirgeyici maddenin varlığını varsayar. Nitrik okside (4) dönüşerek NO2 oluşturur

Bu reaksiyona katsayılar koymak için elektronik bir denge kuracağız.
P0, 5e = P+5'i verir
N+5, e = N+4'ü alır
Bunu daha önce göz önünde bulundurarak Nitrik asit ve nitrojen oksidin (4) katsayısı 5 olmalıdır, bitmiş reaksiyonu elde ederiz:
P + 5HNO3 =5NO2 + H2O + H3PO4
Kimyadaki stereokimyasal katsayılar çeşitli hesaplama problemlerinin çözülmesini mümkün kılar.
Üçüncü örnek
Katsayıların düzenlenmesinin birçok lise öğrencisi için zorluk yarattığı göz önüne alındığında, işlem sırasının uygulanması gerekmektedir. spesifik örnekler. Tamamlanması redoks reaksiyonunda katsayıların düzenlenmesine yönelik metodoloji bilgisi gerektiren bir görevin başka bir örneğini sunuyoruz.
H2S + HMnO4 = S + MnO2 +…

Önerilen görevin özelliği, eksik reaksiyon ürününün tamamlanmasının gerekli olmasıdır ve ancak bundan sonra katsayıları belirlemeye devam edebiliriz.
Bileşiklerdeki her bir elementin oksidasyon durumlarını düzenledikten sonra, manganezin oksitleyici özellikler sergileyerek değerini düşürdüğü sonucuna varabiliriz. Önerilen reaksiyondaki indirgeme yeteneği, kükürtün basit bir maddeye indirgenmesiyle gösterilmektedir. Elektronik teraziyi derledikten sonra tek yapmamız gereken katsayıları önerilen süreç diyagramında düzenlemek. Ve bitti.
Dördüncü örnek
Kimyasal bir denklem, maddelerin kütlesinin korunumu yasası tam olarak gözlendiğinde tam bir süreç olarak adlandırılır. Bu model nasıl kontrol edilir? Reaksiyona giren aynı türden atomların sayısı, reaksiyon ürünleri içindeki sayılarına karşılık gelmelidir. Ancak bu durumda kaydedilenlerin kullanışlılığından bahsetmek mümkün olacaktır. kimyasal etkileşim hesaplamaları yapmak, hesaplama problemlerini çözmek için kullanılma olasılığı farklı seviyeler zorluklar. Eksik stereokimyasal katsayıların reaksiyona yerleştirilmesini içeren görevin bir çeşidi aşağıda verilmiştir:
Si + …+ HF = H2SiF6 + HAYIR +…

Görevin zorluğu hem başlangıç maddelerinin hem de reaksiyon ürünlerinin eksik olmasıdır. Tüm elementlerin oksidasyon durumlarını ayarladıktan sonra önerilen görevdeki silikon atomunun indirgeyici özellikler sergilediğini görüyoruz. Reaksiyon ürünleri arasında nitrojen (II) mevcuttur; başlangıç bileşiklerinden biri nitrik asittir. Mantıksal olarak reaksiyonun eksik ürününün su olduğunu belirleriz. Son aşama, elde edilen stereokimyasal katsayıların reaksiyona yerleştirilmesi olacaktır.
3Si + 4HNO3 + 18HF = 3H2SiF6 + 4NO + 8 H2O
Denklem problemi örneği
Karbürünün hidrolizi sırasında oluşan kalsiyum hidroksitin tamamen nötralize edilmesi için yoğunluğu 1.05 g/ml olan %10'luk hidrojen klorür çözeltisinin hacminin belirlenmesi gerekir. Hidroliz sırasında açığa çıkan gazın 8,96 litre (n.s.) hacim kapladığı bilinmektedir. Görevle başa çıkabilmek için önce kalsiyum karbürün hidroliz işlemi için bir denklem oluşturmanız gerekir:
CaC2 + 2H2O = Ca(OH)2 + C2H2
Kalsiyum hidroksit, hidrojen klorür ile reaksiyona girer ve tam nötrleştirme meydana gelir:
Ca(OH)2 + 2HCl = CaCl2 + 2H2O

Bu işlem için gerekli olacak asit kütlesini hesaplıyoruz.
Kimyasal denklemlerde katsayılar ve indeksler
Hidrojen klorür çözeltisinin hacmini belirleyin. Soruna ilişkin tüm hesaplamalar, önemlerini doğrulayan stereokimyasal katsayılar dikkate alınarak yapılır.
Nihayet
Kimyadaki birleşik devlet sınavının sonuçlarının analizi, denklemlerde stereokimyasal katsayıların ayarlanması, elektronik dengenin oluşturulması ve bir oksitleyici madde ile bir indirgeyici maddenin belirlenmesi ile ilgili görevlerin modern ortaokul mezunları için ciddi zorluklara neden olduğunu göstermektedir. Ne yazık ki, modern mezunların bağımsızlık derecesi neredeyse minimum düzeydedir, bu nedenle lise öğrencileri, öğretmen tarafından önerilen teorik temeli uygulamamaktadır.
Arasında tipik hatalar okul çocuklarının reaksiyonlardaki katsayıları düzenlerken varsaydıkları farklı şekiller, bir sürü matematik hatası. Örneğin, herkes en küçük ortak katı nasıl bulacağını veya sayıları doğru şekilde bölüp çarpacağını bilemez. Bu olgunun nedeni, eğitim okullarında bu konuyu incelemek için ayrılan saat sayısının azalmasıdır. Şu tarihte: temel program kimyada öğretmenlerin redoks sürecinde elektronik dengenin hazırlanmasına ilişkin konuları öğrencileriyle birlikte çalışma fırsatı yoktur.
Eğitim
Kare nedir? Karenin köşeleri, kesiti, düzlemi, denklemi, hacmi, taban alanı ve açısı nasıl bulunur?
Kare nedir sorusunun birçok cevabı olabilir. Her şey bu soruyu kime yönelttiğinize bağlı. Bir müzisyen bir karenin 4, 8, 16, 32 ölçü veya caz doğaçlaması olduğunu söyleyecektir. Çocuk - bu nedir...
Arabalar
Bir arabadaki antifrizi ne sıklıkla değiştirmelisiniz?
Bir arabanın motoru çalışırken, silindirlerinin içindeki gazların sıcaklığı 2000 dereceye ulaşır. Bu nedenle parçalar çok ısınır. güç ünitesi. Motordaki aşırı ısıyı gidermek için...
Arabalar
Termostat arabada nasıl çalışır? Çalışma prensibi
Hiç kimse modern araba soğutma sistemi olmadan yapamazsınız. Yanıcı karışımı işlerken motordan çıkan tüm ısıyı alan kişidir. Pistonlar hareket eder, karışım yanar, bu yüzden iyi bir...
Arabalar
Arabadaki klimayı kendi ellerinizle nasıl şarj edebilirsiniz? Arabanızın klimasını ne sıklıkla şarj etmeniz gerekir? Arabamdaki klimayı nerede şarj edebilirim?
Bugün araba kliması sadece bir lüks değil, aynı zamanda kabinde uygun bir mikro iklimden sorumlu olan bir araç için gerekli bir cihazdır. Neredeyse her şey modern modeller Arabalar iklim kontrolü olmasa da donatılmıştır...
Arabalar
Arabadaki klimayı kendi ellerinizle nasıl temizleyebilirsiniz?
Araç sahipleri, araçlarının ana parçalarının ve mekanizmalarının durumuna sürekli dikkat etmelidir. Sonuçta onları temiz ve iyi durumda tutmak, optimum düzeyde güvenlik elde etmenizi sağlar...
Arabalar
Şanzıman yağı 80W90: özellikleri, seçimi, incelemeleri. Manuel şanzımana ne tür yağ koymalıyım?
Bugün özelliklerini ele alacağımız şanzıman yağı 80W90, 85W90 ve 75W90 viskozite sınıfları arasında ortalama olarak sınıflandırılabilir. Hangi niteliksel özelliklerin birbirinden farklı olduğunu daha ayrıntılı olarak öğrenelim...
Arabalar
Hidrolik direksiyona ne tür yağ koymalıyım? Servo direksiyon yağını değiştirmeye yönelik ipuçları
Aracın diğer bileşenleri ve aksamları gibi hidrolik direksiyon da periyodik bakım gerektirir. Çoğu zaman, tüm önleyici tedbirler çalışma sıvısının değiştirilmesine indirgenir. Çoğu zaman ihtiyacınız olan...
Arabalar
Moskova'da otopark için nasıl ödeme yapılır? Ücretli park etme kuralları
Moskova sürücülerinin hayatını daha kolay hale getirmek için oluşturulmuş ücretli park kuralları bulunmaktadır. Ne park edileceği bir sır değil araç Başkentte bu hiç de kolay değil: Şehrin yol kenarları arabalarla dolu...
Arabalar
Kendi ellerinizle araba aromaları nasıl yapılır
Her araba sahibi, demir atının iç kısmında her zaman hoş ve favori bir kokunun bulunmasını ister. Kimisi kahve kokusundan hoşlanır, kimisi narenciyeden, kimisi ise tazelikten hoşlanır. Ne tür tatlar...
Arabalar
Evde pil nasıl şarj edilir?
Muhtemelen her araç sahibi bitmiş akü sorunuyla karşı karşıya kalmıştır. Arabanın güç kaynağına yeterince dikkat etmezseniz bu sorun her sürücünün başına gelebilir.
SEÇENEK 1
a) Na + O2 -> Na2O d) H2 + F2 -> HF
b) CaCO3-> CaO + CO2 e) H2O + K2O -> KOH
c) Zn + H2SO4 -> H2 + ZnSO4 e) Cu(OH)2 + HNO3 -> Cu(NO3)2 + H2O
Ders 13. Kimyasal denklemlerin yazılması
Tanımları yazın:
a) bileşik reaksiyonu b) ekzotermik reaksiyon c) geri dönüşü olmayan reaksiyon.
a) karbon oksijenle reaksiyona girer ve karbon monoksit (II) oluşur;
b) magnezyum oksit, nitrik asit ve magnezyum nitrat ile reaksiyona girer ve su oluşur;
c) demir (III) hidroksit, demir (III) oksit ve suya ayrışır;
d) metan CH4 oksijen içinde yanar ve karbon monoksit (IV) ve su üretir;
e) nitrik oksit (V), suda çözündüğünde nitrik asit oluşturur.
4. Denklemi kullanarak sorunu çözün:
a) Hidrojen flor ile reaksiyona girdiğinde ne kadar miktarda hidrojen florür oluşur?
b) %80 CaCO3 içeren kireçtaşının ayrışması sırasında hangi kütlede kalsiyum oksit oluşur?
c) %35 safsızlık içeren çinko sülfürik asitle reaksiyona girdiğinde hangi hacim ve kütlede hidrojen açığa çıkar?
SEÇENEK 2
- Katsayıları düzenleyin, kimyasal reaksiyonun türünü belirleyin, formüllerin altındaki maddelerin adlarını yazın:
a) P + O2 -> P2O5 d) H2 + N2 -> NH3
b) CaCO3 + HCl -> CaCl2 + H2O + CO2 e) H2O + Li2O -> LiOH
c) Mg + H2SO4 -> H2 + Mg SO4 e) Ca(OH)2 + HNO3 -> Ca(NO3)2 + H2O
2. Tanımları yazın:
a) ayrışma reaksiyonu b) endotermik reaksiyon c) katalitik reaksiyon.
3. Denklemleri anlatıldığı gibi yazın:
a) karbon oksijenle reaksiyona girer ve karbon monoksit (IV) oluşur;
b) baryum oksit, nitrik asit ve baryum nitrat ile reaksiyona girer ve su oluşur;
c) alüminyum hidroksit, alüminyum oksit ve suya ayrışır;
d) Oksijen ve nitrojende amonyak NH3 yanıkları ve su oluşur;
e) fosfor (V) oksit, suda çözündüğünde fosforik asit oluşturur.
4. Denklemi kullanarak sorunu çözün:
a) Hidrojen nitrojenle reaksiyona girdiğinde ne hacimde amonyak oluşur?
b) %80 CaCO3 içeren mermer hidroklorik asitle reaksiyona girdiğinde hangi kütlede kalsiyum klorür oluşur?
c) %30 safsızlık içeren magnezyum sülfürik asitle reaksiyona girdiğinde hangi hacim ve kütlede hidrojen açığa çıkar?
 Kimyasal denklemler nasıl yazılır? İlk olarak, bileşikteki her bir elementin oksidasyon durumlarının düzenlenmesi önemlidir. Diyelim ki görev verildi: "Reaksiyondaki katsayıları düzenleyin, boşlukları doldurun, oksitleyici maddeyi ve indirgeyici maddeyi belirleyin." Eksik ürünlerden biri su, ikincisi ise potasyum sülfat olacaktır. Elektronik terazinin derlenmesinden sonra son aşama denklemdeki katsayıların ayarlanması olacaktır. Soruna ilişkin tüm hesaplamalar, önemlerini doğrulayan stereokimyasal katsayılar dikkate alınarak yapılır. Okul çocuklarının çeşitli türlerdeki reaksiyonlarda katsayıları düzenlerken yaptıkları tipik hatalar arasında birçok matematiksel hata vardır.
Kimyasal denklemler nasıl yazılır? İlk olarak, bileşikteki her bir elementin oksidasyon durumlarının düzenlenmesi önemlidir. Diyelim ki görev verildi: "Reaksiyondaki katsayıları düzenleyin, boşlukları doldurun, oksitleyici maddeyi ve indirgeyici maddeyi belirleyin." Eksik ürünlerden biri su, ikincisi ise potasyum sülfat olacaktır. Elektronik terazinin derlenmesinden sonra son aşama denklemdeki katsayıların ayarlanması olacaktır. Soruna ilişkin tüm hesaplamalar, önemlerini doğrulayan stereokimyasal katsayılar dikkate alınarak yapılır. Okul çocuklarının çeşitli türlerdeki reaksiyonlarda katsayıları düzenlerken yaptıkları tipik hatalar arasında birçok matematiksel hata vardır.
Her element için belirlenebilecekleri belirli kurallar vardır. Üç elementten oluşan formüllerin oksidasyon durumlarının hesaplanmasında kendi nüansları vardır. Elektronik denge yöntemini kullanarak kimyasal denklemlerin nasıl eşitleneceği hakkında konuşmaya devam edelim. Gerekli koşul sol ve sağ taraftaki her bir elemanın miktarını kontrol etmektir. Katsayılar doğru yerleştirilmişse sayıları aynı olmalıdır.
Cebirsel yöntem
Ampirik formüllere ve kimyasal analize derinlemesine bakmak için elementel analiz hakkında mutlaka bilgi edinin.
Kimya maddeleri, özelliklerini ve dönüşümlerini inceler. Moleküler formda demirin atmosferde yakılması süreci işaret ve sembollerle ifade edilebilir. Maddelerin kütlesinin korunumu kanununa göre ürün formülünün önüne 2 katsayısı konulmalıdır. Daha sonra kalsiyum kontrol edilir. Başlangıç olarak, başlangıç maddeleri ve reaksiyon ürünlerindeki elementlerin her biri için oksidasyon durumlarını atayacağız. Daha sonra hidrojen test edilir.
Kimyasal reaksiyonların eşitlenmesi
Basit bir kimyasal denklemden tam bir sonuç elde etmek için kimyasal reaksiyonların eşitlenmesi gerekir. Karbonla başlayalım.
Kütlenin korunumu yasası, kimyasal reaksiyon sırasında yeni atomların oluşmasını ve eskilerinin yok edilmesini kapsamaz. Her atomun indeksine dikkat edin; bu onların sayısını gösterir. Denklemin sağ tarafındaki maddelerin moleküllerinin önüne indisler ekleyerek oksijen atomlarının sayısını da değiştirmiş olduk. Artık denklemin her iki tarafında da tüm karbon, hidrojen ve oksijen atomlarının sayısı aynıdır.
Bir parantez arkasında bir faktör varsa, parantez içindeki her öğenin onunla çarpıldığını söylüyorlar. Oksijen ve hidrojenden daha az olduğu için nitrojenle başlamanız gerekir. Harika, hidrojen dengelendi. Sırada baryum var. Eşitlenmiştir, dokunmanıza gerek yoktur. Reaksiyondan önce iki klor var, reaksiyondan sonra sadece bir tane var. Ne yapılması gerekiyor? Şimdi, az önce belirlenen katsayıya bağlı olarak reaksiyondan sonra iki sodyum elde ettik ve reaksiyondan önce de iki sodyum elde ettik. Harika, diğer her şey eşitlendi. Bir sonraki adım, oksidasyonun nerede meydana geldiğini ve indirgemenin nerede meydana geldiğini anlamak için her maddedeki tüm elementlerin oksidasyon durumlarını düzenlemektir.

Basit reaksiyonların analizi örneği
Sağ tarafta indeks yok, yani bir oksijen parçacığı, solda ise 2 parçacık var. Ek dizin veya düzeltme yok kimyasal formül Doğru yazıldığı için giremezsiniz. Sağ tarafta ise 2 oksijen iyonu elde etmek için 1 ile 2'yi çarpıyoruz.
Göreve başlamadan önce, kimyasal bir elementin veya formülün tamamının önüne yerleştirilen sayıya katsayı denildiğini anlamalısınız. Analiz etmeye başlayalım. Böylece sonuç, eşittir işaretinden önce ve sonra her elementin aynı sayıda atomudur. Katsayının endeksle çarpıldığını ve toplanmadığını unutmayın.
Aşağıdaki koşullara bağlı olarak herhangi bir belgeyi kendi amaçlarınız doğrultusunda özgürce kullanabilirsiniz:
2) Kimyasal elementlerin sembolleri periyodik tabloda göründükleri biçimde kesinlikle yazılmalıdır.
Bilgi kartı. "Kimyasal reaksiyon denklemlerinde katsayıları düzenlemek için algoritma."
3) Bazen reaktanların ve ürünlerin formüllerinin kesinlikle doğru yazıldığı ancak katsayıların hala atanmadığı durumlar ortaya çıkar. Böyle bir problemin ortaya çıkma olasılığı en yüksek olanı, karbon iskeletinin parçalandığı organik maddelerin oksidasyon reaksiyonlarıdır.
Reaksiyon denklemini sadece yazabilmeniz değil, aynı zamanda okuyabilmeniz de gerekir. Bu nedenle bazen reaksiyon denklemindeki tüm formülleri yazdıktan sonra denklemin her bir kısmındaki atom sayısını eşitlemeniz ve katsayıları ayarlamanız gerekir. Denklemin sol ve sağ taraflarında her bir elementin eşit sayıda atomunun olup olmadığını sayın.
Birçok okul çocuğu için kimyasal reaksiyonların denklemlerini yazmak ve katsayıları doğru şekilde düzenlemek kolay bir iş değildir. Ama sadece birkaçını hatırlaman gerekiyor Basit kurallar ve görev artık zorluklara neden olmayacak. Katsayı yani molekülün formülünün önündeki sayı kimyasal madde, tüm karakterlere uygulanır ve her karakterin her dizini ile çarpılır!
13. derste "" dersten " Aptallar için kimya» Kimyasal denklemlere neden ihtiyaç duyulduğunu düşünün; kimyasal reaksiyonları eşitlemeyi öğrenelim doğru yerleştirme katsayılar Bu ders, önceki derslerdeki temel kimyayı bilmenizi gerektirecektir. Ampirik formüllere ve kimyasal analize derinlemesine bakmak için elementel analiz hakkında mutlaka bilgi edinin.
Metanın CH4'ün oksijen O2'deki yanma reaksiyonu sonucunda karbondioksit CO2 ve su H2O oluşur. Bu reaksiyon tarif edilebilir. kimyasal denklem:
- CH4 + O2 → CO2 + H2O (1)
Kimyasal bir denklemden sadece bir göstergeden daha fazla bilgi çıkarmaya çalışalım ürünler ve reaktifler reaksiyonlar. Kimyasal denklem (1) TAMAMLANMAMIŞTIR ve bu nedenle 1 CH4 molekülü başına kaç O2 molekülü tüketildiği ve bunun sonucunda kaç CO2 ve H2 O molekülü elde edildiği hakkında herhangi bir bilgi sağlamamaktadır. Ancak ilgili olandan önce yazarsanız moleküler formüller Reaksiyona her türden kaç molekülün katıldığını gösteren sayısal katsayılar, o zaman şunu elde ederiz: tam kimyasal denklem reaksiyonlar.
Kimyasal denklemin (1) kompozisyonunu tamamlamak için basit bir kuralı hatırlamanız gerekir: Denklemin sol ve sağ tarafları, her türden aynı sayıda atom içermelidir, çünkü kimyasal reaksiyon sırasında yeni atom oluşmaz. yaratılanlar yok edilmez. Bu kural, bölümün başında tartıştığımız kütlenin korunumu yasasına dayanmaktadır.
Basit bir kimyasal denklemden tam bir sonuç elde etmek için gereklidir. O halde, gerçek reaksiyon denklemine (1) geçelim: kimyasal denkleme, tam olarak sağ ve sol taraftaki atom ve moleküllere bir kez daha bakalım. Reaksiyonun üç tür atom içerdiğini görmek kolaydır: karbon C, hidrojen H ve oksijen O. Kimyasal denklemin sağ ve sol taraflarında her tür atomun sayısını sayıp karşılaştıralım.

Karbonla başlayalım. Sol tarafta bir C atomu CH4 molekülünün bir parçasıdır ve sağ tarafta bir C atomu CO2'nin bir parçasıdır. Böylece sol ve sağ tarafta karbon atomu sayısı aynı olduğundan onu kendi haline bırakıyoruz. Ancak netlik sağlamak için karbonlu moleküllerin önüne 1 katsayısını koyalım, ancak bu gerekli değildir:
- 1CH4 + O2 → 1CO2 + H2O (2)
Daha sonra H hidrojen atomlarını saymaya geçiyoruz. CH4 molekülünde sol tarafta 4 H atomu (kantitatif anlamda H4 = 4H) var, sağ tarafta ise sadece 2 H atomu var H 2 O molekülü, kimyasal denklemin (2) sol tarafındakinden iki kat daha azdır. Haydi eşitleyelim! Bunu yapmak için H 2 O molekülünün önüne 2 katsayısı koyalım. Şimdi hem reaktanlarda hem de ürünlerde 4 molekül hidrojen H'ye sahip olacağız:
- 1CH4 + Ö2 → 1CO2 + 2H2Ö (3)
Hidrojen H'yi eşitlemek için H 2 O su molekülünün önüne yazdığımız 2 katsayısının, bileşiminde yer alan tüm atomları 2 kat artırdığını, yani. 2H 2 O, 4H ve 2O anlamına gelir. Tamam, bunu çözdük gibi görünüyor, geriye kalan tek şey O'daki oksijen atomlarının sayısını saymak ve karşılaştırmak. kimyasal denklem(3). Sol tarafta sağa göre tam olarak 2 kat daha az O atomu olduğu hemen göze çarpıyor. Artık kimyasal denklemleri kendiniz nasıl dengeleyeceğinizi zaten biliyorsunuz, bu yüzden hemen nihai sonucu yazacağım:
- 1CH4 + 2O2 → 1CO2 + 2H2O veya CH4 + 2O2 → CO2 + 2H2O (4)
Gördüğünüz gibi kimyasal reaksiyonları eşitlemek o kadar da zor bir şey değil ve burada önemli olan kimya değil matematiktir. Denklem (4) denir tam denklem kimyasal reaksiyon, çünkü kütlenin korunumu yasasına uyar; Reaksiyona giren her türden atom sayısı, reaksiyonun sonunda bu türdeki atomların sayısıyla tam olarak örtüşür. Bu tam kimyasal denklemin her iki tarafı da 1 karbon atomu, 4 hidrojen atomu ve 4 oksijen atomu içerir. Ancak bir çifti anlamaya değer önemli noktalar: Bir kimyasal reaksiyon, bireysel ara aşamaların karmaşık bir dizisidir ve bu nedenle, örneğin, denklem (4)'ü, 1 metan molekülünün 2 oksijen molekülü ile aynı anda çarpışması gerektiği anlamında yorumlamak imkansızdır. Reaksiyon ürünlerinin oluşumu sırasında meydana gelen işlemler çok daha karmaşıktır. İkinci nokta: tam denklem Reaksiyon bize moleküler mekanizması, yani reaksiyonda meydana gelen olayların sırası hakkında hiçbir şey söylemez. Moleküler seviye seyri sırasında.
Kimyasal reaksiyon denklemlerindeki katsayılar
Bir diğer açık örnek nasıl doğru şekilde yerleştirilir ihtimaller kimyasal reaksiyon denklemlerinde: Trinitrotoluen (TNT) C7H5N3O6, H2O, CO2 ve N2'yi oluşturmak için oksijenle kuvvetli bir şekilde birleşir. Eşitleyeceğimiz reaksiyon denklemini yazalım:
- C 7 H 5 N 3 Ö 6 + Ö 2 → CO 2 + H 2 Ö + N 2 (5)
Denklemin tamamını iki TNT molekülüne dayanarak oluşturmak daha kolaydır, çünkü sol taraf tek sayıda hidrojen ve nitrojen atomu içerir ve sağ taraf çift sayı içerir:
- 2C 7 H 5 N 3 Ö 6 + Ö 2 → CO 2 + H 2 O + N 2 (6)
O halde 14 karbon atomu, 10 hidrojen atomu ve 6 nitrojen atomunun 14 molekül karbondioksit, 5 molekül su ve 3 molekül nitrojene dönüşmesi gerektiği açıktır:
- 2C 7 H 5 N 3 Ö 6 + Ö 2 → 14CO 2 + 5H 2 Ö + 3N 2 (7)
Artık her iki parça da oksijen dışındaki tüm atomlardan aynı sayıda içerir. Denklemin sağ tarafında bulunan 33 oksijen atomundan 12'si iki orijinal TNT molekülü tarafından sağlanır, geri kalan 21'i ise 10,5 O2 molekülü tarafından sağlanmalıdır. Böylece tam kimyasal denklem şöyle görünecektir:
- 2C 7 H 5 N 3 Ö 6 + 10,5O 2 → 14CO 2 + 5H 2 Ö + 3N 2 (8)
Her iki tarafı da 2 ile çarpabilir ve tam sayı olmayan 10,5 katsayısından kurtulabilirsiniz:
- 4C 7 H 5 N 3 Ö 6 + 21O 2 → 28CO 2 + 10H 2 Ö + 6N 2 (9)
Ancak denklemin tüm katsayılarının tam sayı olması gerekmediğinden bunun yapılmasına gerek yoktur. Tek bir TNT molekülüne dayalı bir denklem oluşturmak daha da doğru olacaktır:
- C 7 H 5 N 3 Ö 6 + 5,25O 2 → 7CO 2 + 2,5H 2 Ö + 1,5N 2 (10)
Tam kimyasal denklem (9) birçok bilgi içerir. Her şeyden önce başlangıç maddelerini belirtir - reaktifler, Ve ürünler reaksiyonlar. Ayrıca reaksiyon sırasında her türden atomun ayrı ayrı korunduğunu gösterir. Denklemin (9) her iki tarafını da Avogadro sayısı NA = 6,022 10 23 ile çarparsak, 4 mol TNT'nin 21 mol O 2 ile reaksiyona girerek 28 mol CO 2, 10 mol H 2 O ve 6 mol TNT'yi oluşturduğunu söyleyebiliriz. N2'nin molleri.
Bir numara daha var. Periyodik tabloyu kullanarak belirlediğimiz moleküler ağırlıklar tüm bu maddeler:
- C7H5N306 = 227,13 g/mol
- O2 = 31,999 g/mol
- CO2 = 44.010 g/mol
- H2O = 18,015 g/mol
- N2 = 28,013 g/mol
Şimdi denklem 9 ayrıca 4 227,13 g = 908,52 g TNT'nin reaksiyonu tamamlamak için 21 31,999 g = 671,98 g oksijen gerektirdiğini ve bunun sonucunda 28 44,010 g = 1232,3 g CO2 oluştuğunu, 10·18,015 g = 180,15 olduğunu gösterecektir. g H2O ve 6·28,013 g = 168,08 g N2. Bu reaksiyonda kütlenin korunumu yasasının sağlanıp sağlanmadığını kontrol edelim:
| Reaktifler | Ürünler | |
| 908,52 gram TNT | 1232,3 gr CO2 | |
| 671,98 gr CO2 | 180,15 gr H2O | |
| 168,08 gr N2 | ||
| Toplam | 1580,5 gr | 1580,5 gr |
Ancak tek tek moleküllerin mutlaka bir kimyasal reaksiyona katılması gerekmez. Örneğin kireçtaşı CaCO3 ve hidroklorik asit HCl, kalsiyum klorür CaCl2 ve karbon dioksit CO2'den oluşan sulu bir çözelti oluşturmak için:
- CaCO3 + 2HCl → CaCl2 + C02 + H20 (11)
Kimyasal denklem (11), kalsiyum karbonat CaC03 (kireç taşı) ve hidroklorik asit HCl'nin sulu bir kalsiyum klorür CaCl2 ve karbon dioksit CO2 çözeltisi oluşturmak üzere reaksiyonunu açıklar. Bu denklem tamamlandı çünkü her türün sol ve sağ taraflarındaki atom sayısı aynı.
Bu denklemin anlamı makroskobik (molar) seviyeşu şekildedir: 1 mol veya 100,09 g CaC03, reaksiyonun tamamlanması için 2 mol veya 72,92 g HC1 gerektirir, sonuçta 1 mol CaCl2 (110,99 g/mol), CO2 (44,01 g/mol) ve H2 oluşur O (18.02 g/mol). Bu sayısal verilerden, bu reaksiyonda kütlenin korunumu yasasının karşılandığını doğrulamak kolaydır.
Denklemin (11) yorumlanması mikroskobik (moleküler) seviye Kalsiyum karbonat moleküler bir bileşik değil, bir tuz olduğundan bu durum çok açık değildir ve bu nedenle kimyasal denklem (11), 1 molekül kalsiyum karbonat CaC03'ün 2 molekül HCl ile reaksiyona girmesi anlamında anlaşılamaz. Ayrıca çözeltideki HCl molekülü genellikle H+ ve Cl- iyonlarına ayrışır (parçalanır). Daha fazla doğru açıklama Bu reaksiyonda moleküler düzeyde ne olacağı aşağıdaki denklemle verilmektedir:
- CaCO3 (sol.) + 2H + (sulu) → Ca2+ (sulu) + CO2 (g.) + H2O (l.) (12)
Burada her bir parçacık türünün fiziksel durumu kısaca parantez içinde belirtilmektedir ( televizyon- zor, aq.- hidratlanmış iyon sulu çözelti, G.- gaz, Ve.- sıvı).
Denklem (12), katı CaCO3'ün iki hidratlı H+ iyonu ile reaksiyona girerek pozitif iyon Ca2+, CO2 ve H2O'yu oluşturduğunu gösterir. Denklem (12), diğer tam kimyasal denklemler gibi, hakkında bir fikir vermez. moleküler mekanizma reaksiyonları ve madde miktarının sayılması için daha az uygundur, ancak şunu verir: en iyi açıklama Mikroskobik düzeyde oluyor.
Kendiniz bir çözüm içeren bir örnek üzerinde çalışarak kimyasal denklemler oluşturma bilginizi güçlendirin:
Umarım 13. dersten itibaren" Kimyasal Denklemlerin Yazılması"Kendin için yeni bir şey öğrendin. Sorularınız varsa yorumlara yazın.
Öğretmen esastır aktör Organizasyonda bilişsel aktiviteÖğrenciler sürekli olarak öğrenme verimliliğini artırmanın yollarını arıyorlar. Etkili öğretimin organizasyonu ancak pedagojik sürecin çeşitli biçimlerinin bilgi ve ustalıkla kullanılmasıyla mümkündür.
1. Modern adam sadece bilgi ve becerilerin toplamına değil, aynı zamanda dünyayı tek, karmaşık, sürekli gelişen bir bütün olarak algılama yeteneğine de sahip olmalıdır.
İndirmek:
Ön izleme:
Kimya makalesi: “Kimyasal denklemlerde katsayıların düzenlenmesi”
Derleyen: kimya öğretmeni
GBOU Ortaokulu No: 626
Kazutina O.P.
Moskova 2012
“Kimyasal denklemlerde katsayıların düzenlenmesi”
Öğrencilerin bilişsel faaliyetlerini organize etmede ana karakter olan öğretmen, sürekli olarak öğrenmenin etkinliğini artırmanın yollarını aramaktadır. Etkili öğretimin organizasyonu ancak pedagojik sürecin çeşitli biçimlerinin bilgi ve ustalıkla kullanılmasıyla mümkündür.
1. Modern bir insan, yalnızca bir miktar bilgi ve beceriye değil, aynı zamanda dünyayı tek, karmaşık, sürekli gelişen bir bütün olarak algılama yeteneğine de sahip olmalıdır.
Derse hazırlanma algoritması
konu seçimi, hedeflerin tanımlanması;
içerik seçimi;
öğrencilerin sınıfta çalışmaya yönelik olumlu motivasyonel tutumlarını geliştirmenin araçlarını ve yollarını belirlemek;
dersin gerekli görsel ve didaktik materyalle donatılmasının belirtilmesi;
ders planı geliştirme
Öğretmenler için “Kimyasal denklemde katsayıların düzenlenmesi” kimya dersi örneği
Hedef: şu soruyu cevaplayın: "katsayıları neden bir kimyasal denklemde yerleştirmeniz gerekiyor?"
Görevler:
Katsayı atama ihtiyacı sorunu
Katsayıları ayarlamak için algoritma
Katsayılar düzenlemesinin anlamının kanıtı
Dersler sırasında:
Çağdaş bir öğrenci, eğer çalışıyorsa, aldığı ve işlediği bilgiye pragmatizmle yaklaşır. Bu nedenle sağlanan materyalin kafanıza mantıklı ve özlü bir şekilde sığması gerekir.
Bunu başarmak için öğretmen her zaman şunlara dikkat etmelidir: Ne için şu ya da bu eylemin sınıfta öğrenilmesi gerekir. Yani öğretmen açıklamalıdır. Ve sonra, iyi bir şekilde, yeni konuyla ilgili doğru soruları bekleyin.
Maddelerin kütlesinin korunumu kanunu
Çeşitli metalleri açık bir imbikte kalsine eden ve ısıtmadan önce ve sonra tartan ünlü İngiliz kimyager R. Boyle, metal kütlesinin büyüdüğünü keşfetti. Bu deneylere dayanarak havanın rolünü hesaba katmadı ve kimyasal reaksiyonların bir sonucu olarak madde kütlesinin değiştiği yönünde yanlış sonuca vardı. R. Boyle, bir metal ısıtıldığında metalle birleşerek kütlesini artıran bir tür "ateşli madde" olduğunu savundu.
Mg + O 2 MgO
24 gr 40 gr
M.V. Lomonosov, R. Boyle'un aksine, metalleri kalsine etmedi. açık havada ve mühürlü imbiklerde kalsinasyondan önce ve sonra tartıldı. Reaksiyondan önce ve sonra madde kütlesinin değişmeden kaldığını ve kalsinasyon sırasında havanın bir kısmının metale eklendiğini kanıtladı. (O dönemde oksijen henüz keşfedilmemişti.) Bu deneylerin sonuçlarını bir kanun halinde formüle etti: "Doğada meydana gelen bütün değişiklikler öyle hallerdir ki, bir cisimden alınan şey diğerine eklenir." Şu anda bu yasa aşağıdaki şekilde formüle edilmiştir:
Kimyasal reaksiyona giren maddelerin kütlesi, oluşan maddelerin kütlesine eşittir
Mg + O 2 MgO
24 gr 32 gr 40 gr
Soru: Kanun tatmin edici değil (çünkü başlangıç ve son maddelerin kütleleri eşit değil).
Bu problemin çözümü katsayıların (molekül sayısını gösteren tam sayılar) düzenlenmesidir:
2Mg + O2 2MgO
48 g 32 g 80 g – Elementlerin atom sayısının reaksiyondan önce ve sonra eşit olması nedeniyle önceki ve sonraki kütleler eşittir.
Böylece, öğrencilere kütle katsayılarını eşitleme ihtiyacını kanıtladıktan sonra, önceki konuların bazıları olmadan bile yapabilirsiniz: değerliklere göre maddeler için formüller hazırlamak, kütleyi hesaplamak, madde miktarı... Ayrıca yasanın gerçeğiyle ilgili bir hikaye Madde kütlesinin korunumu fikri, 20 yıl sonra A. Lavoisier tarafından bir yandan bunu açıklığa kavuşturarak, ancak M.V.'ye tamamen dikkat etmeden "yeniden keşfedildi". Lomonosov'un etik kuralları varsa, onu bırakabilirsin bireysel çalışmaörneğin bir rapor şeklinde.
Dolayısıyla, bu tür görevleri başarıyla tamamlamak için şu koşulu anlamanız gerekir: db reaksiyonundan önceki atom sayısı reaksiyondan sonraki atom sayısına eşittir: gelin birlikte çözelim:
H 2 S + 3O 2 SO 2 + 2H 2 O (sağda oksijenleri ikiye katlıyoruz. Solda sayıyoruz)
CH 4 + 2O 2 CO 2 + 2H 2 O
Katsayıları iki gazın yanma denklemlerine yerleştirdik.
