Существует несколькометодов определения коэффициентов вуравнениях окислительно-восстановительныхреакций. Мы используем метод электронногобаланса, при котором составление полногоуравнения ОВР проводится в следующейпоследовательности:
1. Составляют схемуреакции, указав вещества, вступившие вреакцию, и вещества, получившиеся врезультате реакции, например:
2. Определяютстепень окисления атомов и пишут еезнак и величину над символами элементов,отмечая элементы, степень окислениякоторых изменилась:
3. Записываютэлектронные уравнения реакций окисленияи восстановления, определяют числоэлектронов, отданных восстановителеми принятых окислителем, и затем уравниваютих, умножая на соответствующиекоэффициенты:
4. Полученныекоэффициенты, отвечающие электронномубалансу, переносят в основное уравнение:
5.Уравниваютчисло атомов и ионов, не меняющих степениокисления (в последовательности: металлы,неметаллы, водород):
6.Проверяютправильность подбора коэффициентов почислу атомов кислорода в левой и правойчасти уравнения реакции – они должныбыть равны (в этом уравнении 24 = 18 + 2 + 4,24 = 24).
Рассмотрим болеесложный пример:
Определим степениокисления атомов в молекулах:
Составим электронныеуравнения реакций окисления ивосстановления и уравняем число отданныхи принятых электронов:
Перенесемкоэффициенты в основное уравнение:
Уравняем числоатомов, не меняющих степень окисления:
Подсчитав числоатомов кислорода в правой и левой частиуравнения, убедимся, что коэффициентыподобраны правильно.
Важнейшие окислители и восстановители
Окислительно-восстановительныесвойства элементов зависят от строенияэлектронной оболочки атомов и определяютсяих положением в периодической системеМенделеева.
Металлы, имея навнешнем энергетическом уровне 1-3электрона, легко их отдают и проявляюттолько восстановительные свойства.Неметаллы (элементы IV-VIIгрупп) могут как отдавать, так и приниматьэлектроны, поэтому они могут проявлятьи восстановительные и окислительныесвойства. В периодах с увеличениемпорядкового номера элементавосстановительные свойства простыхвеществ ослабевают, а окислительныеусиливаются. В группах с повышениемпорядкового номера восстановительныесвойства усиливаются, а окислительныеослабевают. Таким образом, изпростых веществ лучшими восстановителямиявляются щелочные металлы, алюминий,водород, углерод; лучшими окислителямиявляются галогены и кислород.
Окислительно-восстановительныесвойства сложных веществ зависят отстепени окисления атомов, входящих вих состав. Вещества,содержащие атомы с низшей степеньюокисления, проявляют восстановительныесвойства.Важнейшими восстановителями являютсяоксид углерода ,сероводород
,сероводород ,сульфат железа(II)
,сульфат железа(II) .Вещества,в состав которых входят атомы с высшейстепенью окисления, проявляют окислительныесвойства.Важнейшими окислителями являютсяперманганат калия
.Вещества,в состав которых входят атомы с высшейстепенью окисления, проявляют окислительныесвойства.Важнейшими окислителями являютсяперманганат калия ,дихромат калия
,дихромат калия ,пероксид водорода
,пероксид водорода ,азотная кислота
,азотная кислота ,концентрированная серная кислота
,концентрированная серная кислота .
.
Вещества,содержащие атомы с промежуточнойстепенью окисления, могут вести себякак окислители или восстановителив зависимости от свойств веществ, скоторыми они взаимодействуют, и условийпротекания реакции. Так в реакции с сернистая кислота проявляетвосстановительные свойства:
сернистая кислота проявляетвосстановительные свойства:
а при взаимодействиис сероводородом является окислителем:

Кроме того, длятаких веществ возможны реакциисамоокисления-самовосстановления,протекающие с одновременным увеличениеми уменьшением степени окисления атомоводного и того же элемента, например:
Сила многихокислителей и восстановителей зависитот рН среды. Например,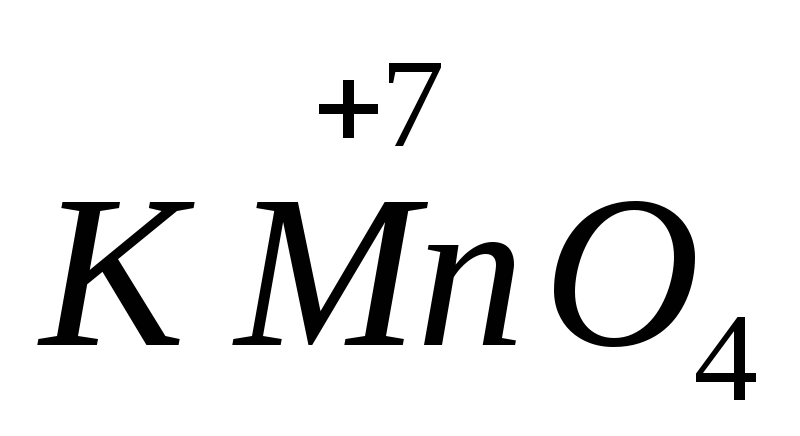 в щелочной среде восстанавливается до
в щелочной среде восстанавливается до ,в нейтральной до
,в нейтральной до ,в присутствии серной кислоты — до
,в присутствии серной кислоты — до .
.
Алгоритм
Расстановка коэффициентов в уравнениях химических реакций
Учитель химии МБОУ ОСОШ №2
Володченко Светлана Николаевна
г Уссурийск
РАССТАНОВКА КОЭФФИЦИЭНТОВ В УРАВНЕНИЯХ ХИМИЧЕСКИХ РЕАКЦИЙ
Число атомов одного элемента в левой части уравнения должно быть равно числу атомов этого элемента в правой части уравнения.
Задание 1 (для групп).Определите число атомов каждого химического элемента, участвующего в реакции.
1. Вычислите число атомов:
а)водорода: 8NH3, NaOH, 6NaOH, 2NaOH,НзРО4, 2H2SO4, 3H2S04, 8H2SO4;
6)кислорода: C02, 3C02, 2C02, 6CO, H2SO4, 5H2SO4, 4H2S04, HN03.
2. Вычислите число атомов: а)водорода:
1) NaOH + HCl 2)CH4+H20 3)2Na+H2
б) кислорода:
1) 2СО + 02 2) С02 + 2Н.О. 3)4NO2 + 2H2O + O2
Алгоритм расстановки коэффициентов в уравнениях химических реакций
А1 + О2→ А12О3
А1-1 атом А1-2
О-2 атома О-3
2. Среди элементов с разным числом атомов в левой и правой частях схемы выбрать тот, число атомов которого больше
О-2 атома слева
О-3 атома справа
3. Найти наименьшее общее кратное (НОК) числа атомов этого элемента в левой части уравнения и числа атомов этого элемента в правой части уравнения
НОК = 6
4. Разделить НОК на число атомов этого элемента в левой части уравнения, получить коэффициент для левой части уравнения
6:2 = 3
Аl + ЗО2→Аl2О3
5. Разделить НОК на число атомов этого элемента в правой части уравнения, получить коэффициент для правой части уравнения
6:3 = 2
А1+ О2→2А12О3
6. Если выставленный коэффициент изменил число атомов еще какого-либо элемента, то действия 3, 4, 5 повторить еще раз.
А1 + ЗО2→ →2А12О3
А1 -1 атом А1 — 4
НОК = 4
4:1=4 4:4=1
4А1 + ЗО2→→2А12О3
.Первичная проверка усвоения знаний(8-10 мин.).
В левой части схемы два атома кислорода, а в правой — один. Число атомов нужно выровнять с помощью коэффициентов.
1)2Mg+O2 →2MgO
2) СаСО3+ 2HCl→ СаСl2 + Н2О + СО2
Задание 2Расставьте коэффициенты в уравнениях химических реакций (обратите внимание, что коэффициент изменяет число атомов только одного элемента):
1. Fe2O3 + Аl→ Аl2О3 + Fe; Mg + N2→ Mg3N2;
2. Al + S→ Al2S3; A1 +С→Al4C3;
3. Al + Cr2O3→Cr + Al2O3; Ca + P→Ca3P2;
4. С +H2→CH4; Ca + С→СаС2;
5. Fe + O2→Fe3O4; Si + Mg→Mg2Si;
6/.Na + S→Na2S; CaO +С→CaC2 + CO;
7. Ca + N2→Ca3N2; Si + Cl2→SiCl4;
8. Ag + S→Ag2S;Н2 +Сl2→НСl;
9. N2+ O2→NO;СО2+С→СО;
10. HI →Н2→+ 12; Mg +НСl→ MgCl2 +Н2;
11. FeS +НС1→ FeCl2 + H2S; Zn+ HCl→ ZnCl2 + H2;
12. Br2+ KI→KBr+ I2; Si + HF(r)→ SiF4 + H2;
1./ HCl+Na2CO3→CO2+H2O+ NaCl; KClO3 + S→→KCl+ SO2;
14. Cl2+ KBr→ KCl + Br2; SiO2 +С→ Si + CO;
15. SiO2 +С→ SiC + CO; Mg + SiO2→ Mg2Si + MgO
16.Mg2Si +HCl→MgCl2+SiH4
1.Что такое уравнение химической реакции?
2.Что записывают в правой части уравнения? А в левой?
3.Что означает знак «+» в уравнении?
4. Зачем расставляют коэффициенты в уравнениях хим
Для того чтобы выяснить, как уравнять химическое уравнение, для начала следует узнать предназначение данной науки.
Определение
Химия изучает вещества, их свойства, а также превращения. В случае если не наблюдается изменения окраски, выпадения осадка, выделения газообразного вещества, то не происходит никакого химического взаимодействия.
Например, при обработке напильником железного гвоздя металл просто превращается в порошок. В этом случае никакой химической реакции не происходит.
Прокаливание перманганата калия сопровождается образованием оксида марганца (4), выделением кислорода, то есть наблюдается взаимодействие. При этом возникает вполне закономерный вопрос о том, как правильно уравнивать химические уравнения. Разберем все нюансы, связанные с подобной процедурой.

Специфика химических превращений
Любые явления, которые сопровождаются изменением качественного и количественного состава веществ, относятся к химическим превращениям. В молекулярном виде процесс сгорания железа в атмосфере можно выразить с помощью знаков и символов.
Методика расстановки коэффициентов
Как уравнивать коэффициенты в химических уравнениях? В курсе химии средней школы разбирается метод электронного баланса. Рассмотрим процесс более подробно. Для начала в исходной реакции необходимо расставить степени окисления у каждого химического элемента.
Существуют определенные правила, по которым их можно определить у каждого элемента. В простых веществах степени окисления будут равны нулю. В бинарных соединениях у первого элемента она положительна, соответствует высшей валентности. У последнего данный параметр определяется путем вычитания номера группы из восьми и имеет знак «минус». В формулах, состоящих их трех элементов, есть свои нюансы вычисления степеней окисления.
Для первого и последнего элемента порядок аналогичен определению в бинарных соединениях, а для вычисления центрального элемента составляется уравнение. Сумма всех показателей должна быть равна нулю, исходя из этого, вычисляется показатель для среднего элемента формулы.
Продолжим разговор о том, как уравнивать химические уравнения методом электронного баланса. После того как степени окисления будут поставлены, можно определять те ионы либо вещества, которые в ходе химического взаимодействия изменили их значение.
Знаками «плюс» и «минус» необходимо указать количество электронов, которые были приняты (отданы) в процессе химического взаимодействия. Между полученными цифрами находят наименьшее общее кратное.
При делении его на принятые и отданные электроны получают коэффициенты. Как уравнять химическое уравнение? Полученные в балансе цифры нужно поставить перед соответствующими формулами. Обязательным условием является проверка количества каждого элемента в левой и правой части. Если коэффициенты расставлены правильно, их число должно быть одинаковым.

Закон сохранения массы веществ
Рассуждая над тем, как уравнять химическое уравнение, необходимо использовать именно этот закон. Учитывая, что масса тех веществ, которые вступили в химическую реакцию, равна массе образующихся продуктов, становится возможным постановка коэффициентов перед формулами. Например, как уравнять химическое уравнение, если вступают во взаимодействие простые вещества кальций и кислород, а после завершения процесса получается оксид?
Чтобы справиться с поставленной задачей, необходимо учитывать, что кислород является двухатомной молекулой с ковалентной неполярной связью, поэтому его формула записывается в следующем виде — О2. В правой части при составлении оксида кальция (СаО) учитывают валентности каждого элемента.
Сначала необходимо проверить количество кислорода в каждой части уравнения, так как оно отличается. По закону сохранения массы веществ перед формулой продукта нужно поставить коэффициент 2. Далее проводится проверка кальция. Для того чтобы он был уравнен, перед исходным веществом ставим коэффициент 2. В итоге получаем запись:
- 2Са+О2=2СаО.

Разбор реакции методом электронного баланса
Как уравнивать химические уравнения? Примеры ОВР помогут ответить на данный вопрос. Допустим, что необходимо методом электронного баланса расставить коэффициенты в предложенной схеме:
- CuO + Н2=Cu + Н2О.
Для начала у каждого из элементов в исходных веществах и продуктах взаимодействия расставим значения степеней окисления. Получим следующий вид уравнения:
- Cu(+2)О(-2)+Н2(0)=Cu(0)+Н2(+)О(-2).
Показатели изменились у меди и водорода. Именно на их основе будем составлять электронный баланс:
- Cu(+2)+2е=Cu(0) 1 восстановитель, окисление;
- Н2(0)-2е=2Н(+) 1 окислитель, восстановление.
Исходя из коэффициентов, полученных в электронном балансе, получаем следующую запись предложенного химического уравнения:
- CuO+Н2=Cu+Н2О.
Возьмем еще один пример, который предполагает постановку коэффициентов:
- Н2+О2=Н2О.
Для того чтобы уравнять на основе закона сохранения веществ данную схему, необходимо начать с кислорода. Учитывая, что вступала в реакцию двухатомная молекула, перед формулой продукта взаимодействия необходимо поставить коэффициент 2.
- 2Н2+О2=2Н2О.

Заключение
На основании электронного баланса можно расставлять коэффициенты в любых химических уравнениях. Выпускникам девятых и одиннадцатых классов образовательных учреждений, выбирающим экзамен по химии, в одном из заданий итоговых тестов предлагают подобные задания.
РАССТАНОВКА КОЭФФИЦИЭНТОВ
Число атомов одного элемента в левой части уравнения должно быть равно числу атомов этого элемента в правой части уравнения.
Задание 1 (для групп).Определите число атомов каждого химического элемента, участвующего в реакции.
1. Вычислите число атомов:
а) водорода: 8NH3, NaOH, 6NaOH, 2NaOH, НзРО4, 2H2SO4, 3H2S04, 8H2SO4;
6)кислорода: C02, 3C02, 2C02, 6CO, H2SO4, 5H2SO4, 4H2S04, HN03.
2. Вычислите число атомов: а)водорода:
1) NaOH + HCl 2)CH4+H20 3)2Na+H2
б) кислорода:
1) 2СО + 02 2) С02 + 2Н.О. 3)4NO2 + 2H2O + O2
Алгоритм расстановки коэффициентов в уравнениях химических реакций
А1 + О2→ А12О3
А1-1 атом А1-2
О-2 атома О-3
2. Среди элементов с разным числом атомов в левой и правой частях схемы выбрать тот, число атомов которого больше
О-2 атома слева
О-3 атома справа
3. Найти наименьшее общее кратное (НОК) числа атомов этого элемента в левой части уравнения и числа атомов этого элемента в правой части уравнения
НОК = 6
4. Разделить НОК на число атомов этого элемента в левой части уравнения, получить коэффициент для левой части уравнения
6:2 = 3
Аl + ЗО2→Аl2О3
5. Разделить НОК на число атомов этого элемента в правой части уравнения, получить коэффициент для правой части уравнения
6:3 = 2
А1+ О2→2А12О3
6. Если выставленный коэффициент изменил число атомов еще какого-либо элемента, то действия 3, 4, 5 повторить еще раз.
А1 + ЗО2→ →2А12О3
А1 -1 атом А1 — 4
НОК = 4
4:1=4 4:4=1
4А1 + ЗО2→→2А12О3
.Первичная проверка усвоения знаний(8-10 мин.).
В левой части схемы два атома кислорода, а в правой — один. Число атомов нужно выровнять с помощью коэффициентов.
1)2Mg+O2 →2MgO
2) СаСО3+ 2HCl→ СаСl2 + Н2О + СО2
Задание 2Расставьте коэффициенты в уравнениях химических реакций (обратите внимание, что коэффициент изменяет число атомов только одного элемента):
1. Fe2O3 + Аl→ Аl2О3 + Fe; Mg + N2→ Mg3N2;
2. Al + S→ Al2S3; A1 +С→Al4C3;
3. Al + Cr2O3→Cr + Al2O3; Ca + P→Ca3P2;
4. С +H2→CH4; Ca + С→СаС2;
5. Fe + O2→Fe3O4; Si + Mg→Mg2Si;
6/.Na + S→Na2S; CaO +С→CaC2 + CO;
7. Ca + N2→Ca3N2; Si + Cl2→SiCl4;
8. Ag + S→Ag2S;Н2 +Сl2→НСl;
9. N2+ O2→NO;СО2+С→СО;
10. HI →Н2→+ 12; Mg +НСl→ MgCl2 +Н2;
11.FeS +НС1→ FeCl2 + H2S; Zn+ HCl→ ZnCl2 + H2;
12. Br2+ KI→KBr+ I2; Si + HF(r)→ SiF4 + H2;
1./ HCl+Na2CO3→CO2+H2O+ NaCl; KClO3 + S→→KCl+ SO2;
14. Cl2+ KBr→ KCl + Br2; SiO2 +С→ Si + CO;
15. SiO2 +С→ SiC + CO; Mg + SiO2→ Mg2Si + MgO
16.
3.Что означает знак «+» в уравнении?
4. Зачем расставляют коэффициенты в уравнениях хим
Л егко ли расставлять коэффициенты в химических уравнениях?
егко ли расставлять коэффициенты в химических уравнениях?
Вот мои дети и доросли до химии (я классный руководитель в 8 «Б» классе). Химию чаще всего ребятам ставят на первом уроке , а в четверг у меня нет первого урока, и я попросился на урок к Валентине Ивановне «на детей посмотреть» и проверить дневники. Тема меня увлекла, в школе я любил химию, и дневники я не проверил. В очередной раз я убедился , что учащиеся чаще всего испытывают затруднения из-за того, что не видят межпредметных связей. На этом уроке химии учащиеся должны были составить химические уравнения, зная валентность химических веществ. И многие учащиеся испытали затруднения при определении числовых коэффициентов. Следующий урок химии в субботу мы с Валентиной Ивановной провели вместе.
Упражнение 1.
Запишите в виде химических уравнений следующие предложения:
А) «При обжиге карбоната кальция образуются оксид кальция и оксид углерода (IV)»; б) «При взаимодействии оксида фосфора (V) с водой получается фосфорная кислота».
Решение:
А) CaCO 3 = CaO + CO 2 — реакция эндотермическая. С этим заданием затруднений не оказалось, так как не нужно было подыскивать числовые коэффициенты. Изначально в левой и правой частях равенства по одному атому кальция по одному атому углерода и по три атома кислорода.
Б) P 2 O 5 + 3H 2 O = 2H 3 PO 4 — реакция экзотермическая. Со вторым уравнение возникли проблемы , без числовых коэффициентов не получилось верное равенство: P 2 O 5 + H 2 O → H 3 PO 4 . Очевидно, что для составления верного равенства нужно подбирать числовые коэффициенты. Если подбирать, то можно начать с фосфора: слева два атома, а справа – один, поэтому перед формулой азотной кислоты поставим числовой множитель, равный двум и тогда получим: P 2 O 5 + H 2 O → 2H 3 PO 4 . Но теперь осталось уравнять число атомов кислорода и водорода: водорода слева два атома , а справа — шесть атомов, поэтому перед формулой воды поставим числовой коэффициент, равный трём и тогда получим: P 2 O 5 + 3H 2 O → 2H 3 PO 4 . Теперь легко убедиться, что в каждой из частей уравнения равные количества и атомов фосфора и атомов водорода и атомов кислорода , следовательно, мы получили верное уравнение химической реакции: P 2 O 5 + 3H 2 O = 2H 3 PO 4 .
Второй способ: алгебраический.Предположим, что в уравнении поставили три коэффициента а, в, с, что получилось верное уравнение химической реакции: аP 2 O 5 + вH 2 O = сH 3 PO 4 . Так как в уравнении используются атомы трёх видов, то составим систему из трёх линейных уравнений с тремя неизвестными а, ви с.
Вещества, которые использовались в химической реакции: Р – фосфор; О 2 – кислород ; P 2 O 5 – оксид фосфора (V).
В) Fe 2 (SO 4) 3 + KOH → Fe(OH) 3 + K 2 SO 4 .
Решение:) Fe 2 (SO 4) 3 + 6KOH = 2Fe(OH) 3 + 3K 2 SO 4 . Решали подбором: уравняли число атомов железа (2); уравняли число атомов серы (3); уравняли число атомов калия (6); уравняли число атомов кислорода.
Вещества, которые использовались в химической реакции: Fe 2 (SO 4) 3 – сульфат железа (III); KOH – гидроксид калия; Fe(OH) 3 – гидроксид железа (III); K 2 SO 4 – сульфат калия.
Г) CuOH → Cu 2 O + H 2 O.
Решение: 2CuOH = Cu 2 O + H 2 O. Задачу по определению числовых коэффициентов решали , составляя систему уравнений: 
Вещества, которые использовались в химической реакции: CuOH – гидроксид меди (I); Cu 2 O – оксид меди (I); H 2 O – вода.
Д) CS 2 + O 2 → CO 2 + SO 2 .
Решение: CS 2 + 3O 2 = CO 2 + 2SO 2 . Решали подбором коэффициентов: уравняли число атомов серы (2); уравняли число атомов кислорода (3).
Вещества, которые использовались в химической реакции: CS 2 – сульфид серы (IV); O 2 – Вещества, которые использовались в химической реакции: FeS 2 – колчедан; O 2 – кислород; Fe 2 O 3 – оксид железа (III); SO 2 — оксид серы (IV).Упражнение 3.
(Было предложено для решения как самостоятельная работа).
Условие:
Запишите уравнения химических реакций по следующим схемам:
А) фосфорная кислота + гидроксид натрия → фосфат натрия + вода;
Б) оксид натрия + вода → гидроксид натрия;
В) оксид железа (II) + алюминий → оксид алюминия + железо;
Г) гидроксид меди (II)→ оксид меди (II) + вода.
Ответ:
А) 2H 3 PO 4 + 6NaOH = 2Na 3 PO 4 + 6H 2 O;
Б) Na 2 O + H 2 O = 2NaOH;
В) 3FeO + 2Al = Al 2 O 3 + 3Fe;
Г) Cu(OH) 2 = CuO + H 2 O.
За 10 минут 85% учащихся справились с заданием на «отлично», что приятно удивило Валентину Ивановну.
