Kimyoviy reaksiyalar tenglamalarida koeffitsientlarni joylashtiring. Kimyoviy reaksiyalar tenglamalarida koeffitsientlarni tartibga solish mavzusida kimyo darsi (8-sinf)
Oksidlanish-qaytarilish reaksiyalari tenglamalarida koeffitsientlarni aniqlashning bir qancha usullari mavjud. Biz elektron balans usulidan foydalanamiz, unda to'liq OVR tenglamasini tuzish quyidagi ketma-ketlikda amalga oshiriladi:
1. Reaksiyaga kirgan moddalar va reaksiya natijasida hosil bo’lgan moddalar ko’rsatilgan reaksiya diagrammasini tuzing, masalan:
2. Oksidlanish darajasi o‘zgargan elementlarni ko‘rsatib, atomlarning oksidlanish darajasini aniqlang va uning belgisi va qiymatini elementlarning belgilari ustiga yozing:
3. Oksidlanish va qaytarilish reaksiyalarining elektron tenglamalarini yozing, qaytaruvchi tomonidan berilgan va oksidlovchi tomonidan qabul qilingan elektronlar sonini aniqlang, so‘ngra ularni tegishli koeffitsientlarga ko‘paytirish yo‘li bilan tenglashtiring:
4. Elektron balansga mos keladigan olingan koeffitsientlar asosiy tenglamaga o'tkaziladi:
5. Oksidlanish darajasini o'zgartirmaydigan atomlar va ionlar sonini tenglashtiring (ketma-ket: metallar, metall bo'lmaganlar, vodorod):
6. Reaksiya tenglamasining chap va o'ng tomonidagi kislorod atomlari soniga qarab koeffitsientlarni tanlashning to'g'riligini tekshiring - ular teng bo'lishi kerak (bu tenglamada 24 = 18 + 2 + 4, 24 = 24).
Keling, murakkabroq misolni ko'rib chiqaylik:
Molekulalardagi atomlarning oksidlanish darajalarini aniqlaymiz:
Oksidlanish va qaytarilish reaksiyalari uchun elektron tenglamalar tuzamiz va berilgan va qabul qilingan elektronlar sonini tenglashtiramiz:
Koeffitsientlarni asosiy tenglamaga o'tkazamiz:
Oksidlanish darajasini o'zgartirmaydigan atomlar sonini tenglashtiramiz:
Tenglamaning o'ng va chap tomonidagi kislorod atomlari sonini sanab, biz koeffitsientlarning to'g'ri tanlanganligiga ishonch hosil qilamiz.
Eng muhim oksidlovchi va qaytaruvchi moddalar
Elementlarning oksidlanish-qaytarilish xossalari atomlarning elektron qobig'ining tuzilishiga bog'liq bo'lib, ularning Mendeleyev davriy sistemasidagi o'rni bilan belgilanadi.
Tashqi energiya darajasida 1-3 elektronga ega bo'lgan metallar ulardan osongina voz kechadi va faqat kamaytiruvchi xususiyatni namoyon qiladi. Metall bo'lmaganlar (IV-VII guruh elementlari) elektronlarni ham berishi, ham qabul qilishi mumkin, shuning uchun ular ham qaytaruvchi, ham oksidlovchi xususiyatlarni ko'rsatishi mumkin. Elementning atom soni ortgan davrlarda oddiy moddalarning qaytaruvchi xossalari zaiflashadi, oksidlovchi xossalari ortadi. Seriya raqami ortib boruvchi guruhlarda qaytaruvchi xossalari ortadi, oksidlovchi xossalari esa zaiflashadi. Shunday qilib, oddiy moddalardan eng yaxshi qaytaruvchi moddalar ishqoriy metallar, alyuminiy, vodorod, ugleroddir; eng yaxshi oksidlovchi moddalar galogenlar va kisloroddir.
Murakkab moddalarning oksidlanish-qaytarilish xossalari ularni tashkil etuvchi atomlarning oksidlanish darajasiga bog'liq. Eng past oksidlanish darajasiga ega bo'lgan atomlarni o'z ichiga olgan moddalar qaytaruvchi xususiyatga ega. Eng muhim qaytaruvchi moddalar uglerod oksididir  , vodorod sulfidi
, vodorod sulfidi  , temir (II) sulfat
, temir (II) sulfat  .Eng yuqori oksidlanish darajasiga ega bo'lgan atomlarni o'z ichiga olgan moddalar oksidlovchi xususiyatga ega. Eng muhim oksidlovchi moddalar kaliy permanganatdir
.Eng yuqori oksidlanish darajasiga ega bo'lgan atomlarni o'z ichiga olgan moddalar oksidlovchi xususiyatga ega. Eng muhim oksidlovchi moddalar kaliy permanganatdir  , kaliy dixromati
, kaliy dixromati  , vodorod peroksid
, vodorod peroksid  , Azot kislotasi
, Azot kislotasi  , konsentrlangan sulfat kislota
, konsentrlangan sulfat kislota  .
.
O'rta oksidlanish darajasiga ega bo'lgan atomlarni o'z ichiga olgan moddalar oksidlovchi yoki qaytaruvchi sifatida harakat qilishi mumkin. o'zaro ta'sir qiladigan moddalarning xususiyatlariga va reaksiya sharoitlariga bog'liq. Shunday qilib, reaktsiyada  oltingugurt kislotasi kamaytiruvchi xususiyatga ega:
oltingugurt kislotasi kamaytiruvchi xususiyatga ega:
va vodorod sulfidi bilan o'zaro ta'sirlashganda u oksidlovchi vositadir:

Bundan tashqari, bunday moddalar uchun bir xil element atomlarining oksidlanish darajasining bir vaqtning o'zida oshishi va pasayishi bilan sodir bo'ladigan o'z-o'zidan oksidlanish-o'z-o'zini qaytaruvchi reaktsiyalar mumkin, masalan:
Ko'pgina oksidlovchi va qaytaruvchi moddalarning kuchi muhitning pH darajasiga bog'liq. Masalan, 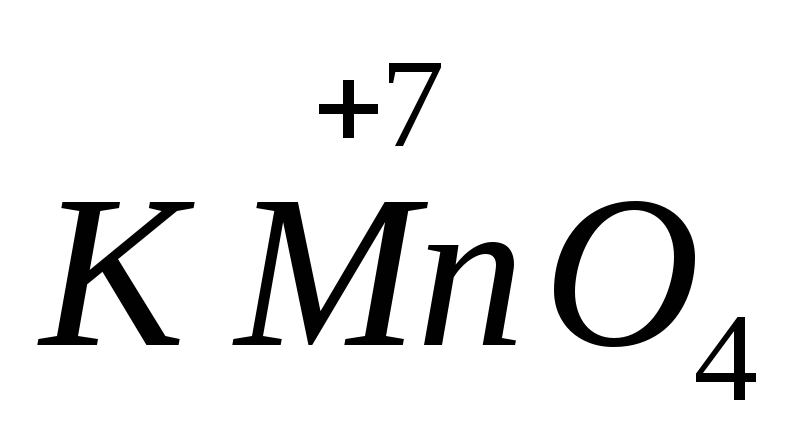 ishqoriy muhitda u kamayadi
ishqoriy muhitda u kamayadi  , neytral holatda
, neytral holatda  , sulfat kislota borligida - gacha
, sulfat kislota borligida - gacha  .
.
Eng oddiy reaksiya tenglamasi:
Fe + S => FeS
Siz nafaqat reaksiya tenglamasini yozishni, balki uni o'qishni ham bilishingiz kerak. Bu tenglama, eng oddiy shaklda, shunday o'qiydi: temir molekulasi oltingugurt molekulasi bilan o'zaro ta'sir qiladi, natijada temir sulfidning bir molekulasi hosil bo'ladi.
Reaksiya tenglamasini yozishda eng qiyin narsa reaksiya mahsulotlari uchun formulalar yaratishdir, ya'ni. hosil bo'lgan moddalar. Bu erda faqat bitta qoida mavjud: molekulalarning formulalari qat'iy ravishda ularni tashkil etuvchi elementlarning valentligiga qarab qurilgan.
Bundan tashqari, reaksiya tenglamalarini tuzishda moddalar massasining saqlanish qonunini esga olish kerak: boshlang'ich moddalar molekulalarining barcha atomlari reaktsiya mahsulotlari molekulalariga kiritilishi kerak. Birorta ham atom yo'q bo'lib ketmasligi yoki kutilmaganda paydo bo'lmasligi kerak. Shuning uchun, ba'zida reaktsiya tenglamasidagi barcha formulalarni yozgandan so'ng, siz tenglamaning har bir qismidagi atomlar sonini tenglashtirishingiz kerak - koeffitsientlarni o'rnating. Mana bir misol:
C + O 2 => CO 2Bu erda har bir element tenglamaning o'ng va chap tomonida bir xil miqdordagi atomlarga ega. Tenglama tayyor.
Cu+O 2 => CuO
Va bu erda tenglamaning chap tomonida o'ngga qaraganda ko'proq kislorod atomlari mavjud. Mis oksidining juda ko'p molekulalarini olish kerak
CuO , shuning uchun ular bir xil miqdordagi kislorod atomlarini o'z ichiga oladi, ya'ni 2. Shuning uchun formulaCuO o'rnatilgan koeffitsient 2:Cu+O2 => 2 CuO
Endi mis atomlarining soni bir xil emas. Tenglamaning chap tomonida, mis belgisidan oldin biz 2 koeffitsientini qo'yamiz:
2 Cu + O2 => 2 CuO
Tenglamaning chap va o'ng tomonlarida har bir elementning atomlari soni teng yoki yo'qligini hisoblang. Ha bo'lsa, reaksiya tenglamasi to'g'ri.
Yana bir misol: Al+O 2 = Al 2 O 3
Va bu erda reaktsiyadan oldin va keyin har bir elementning turli xil atomlari mavjud. Biz gaz bilan - kislorod molekulalari bilan tekislashni boshlaymiz:
1) chap 2 ta kislorod atomi, o'ng tomonda esa 3 ta. Biz bu ikki sonning eng kichik umumiy karralini qidiramiz. Bu eng kichik raqam 2 ga ham, 3 ga ham bo'linadigan, ya'ni 6 ga bo'linadi. Kislorod va alyuminiy oksidi formulalaridan oldinAl 2 O 3 Biz koeffitsientlarni shunday o'rnatamiz umumiy soni Ushbu molekulalarda 6 ta kislorod atomi mavjud edi:
Al+ 3 O 2= 2 Al 2 O 3
2) Biz alyuminiy atomlarining sonini hisoblaymiz: chap tomonda 1 atom, o'ngda esa ikkita molekulada 2 ta atom, ya'ni 4 ta. Tenglamaning chap tomonidagi alyuminiy belgisidan oldin biz 4 koeffitsientini qo'yamiz:
4Al + 3O 2 => 2 Al2O3
3) Reaksiyadan oldin va keyin barcha atomlarni yana bir bor hisoblaymiz: har biri 4 ta alyuminiy atomi va 6 ta kislorod atomi.
Hamma narsa tartibda, reaktsiya tenglamasi to'g'ri. Va agar reaktsiya qizdirilganda sodir bo'lsa, u holda o'qning ustiga qo'shimcha belgi qo'yiladi t.
Kimyoviy reaksiya tenglamasi kimyoviy formulalar va koeffitsientlar yordamida kimyoviy reaksiyaning borishini qayd etishdir.
1. Reaksiya diagrammasini tuzamiz:
Dars maqsadlari.Tarbiyaviy. Talabalarni yangi tasnif bilan tanishtirish kimyoviy reaksiyalar elementlarning oksidlanish darajalarining o'zgarishiga asoslangan - oksidlanish-qaytarilish reaktsiyalari bilan (ORR); talabalarni elektron balans usuli yordamida koeffitsientlarni tartibga solishga o'rgatish.
Rivojlanish. Rivojlanishda davom eting mantiqiy fikrlash, tahlil qilish va taqqoslash ko'nikmalari, fanga qiziqishni rivojlantirish.
Tarbiyaviy. Talabalarning ilmiy dunyoqarashini shakllantirish; mehnat malakalarini oshirish.
Uslublar va metodik texnikalar. Hikoya, suhbat, ko'rgazmali qurollar namoyishi, mustaqil ish talabalar.
Uskunalar va reaktivlar. Rodos Kolossu tasviri bilan ko'paytirish, elektron balans usuli yordamida koeffitsientlarni tartibga solish algoritmi, odatdagi oksidlovchi va qaytaruvchi moddalar jadvali, krossvord; Fe (tirnoq), NaOH, CuSO4 eritmalari.
Darslar davomida
Kirish qismi
(motivatsiya va maqsadni belgilash)
O'qituvchi. 3-asrda. Miloddan avvalgi. Rodos orolida Heliosning (yunonlarning quyosh xudosi) ulkan haykali shaklida yodgorlik qurilgan. Dunyo mo''jizalaridan biri bo'lgan Rodos Kolossining ajoyib dizayni va mukammal ijrosi uni ko'rgan barchani hayratda qoldirdi.
Biz haykalning qanday ko'rinishini aniq bilmaymiz, ammo u bronzadan yasalgani va balandligi taxminan 33 m ga etgani ma'lum bo'lgan haykal haykaltarosh Xaret tomonidan yaratilgan va uni qurish uchun 12 yil kerak bo'lgan.
Bronza qobig'i temir ramkaga biriktirilgan. Bo'shliq haykal pastdan qurila boshlandi va u o'sib ulg'aygan sayin uni yanada mustahkam qilish uchun toshlar bilan to'ldiriladi. Tugallanganidan taxminan 50 yil o'tgach, Kolos qulab tushdi. Zilzila paytida u tizzalar darajasida singan.
Olimlarning fikricha, bu mo''jizaning mo'rtligining asl sababi metall korroziyasi edi. Korroziya jarayoni esa oksidlanish-qaytarilish reaksiyalariga asoslanadi.
Bugun darsda siz redoks reaktsiyalari haqida bilib olasiz; “qaytaruvchi” va “oksidlovchi” tushunchalari, qaytarilish va oksidlanish jarayonlari haqida bilish; Oksidlanish-qaytarilish reaksiyalari tenglamalarida koeffitsientlarni joylashtirishni o'rganing. Darsning sanasi va mavzusini ish daftaringizga yozing.
Yangi materialni o'rganish
O'qituvchi ikkita ko'rgazmali tajriba o'tkazadi: mis (II) sulfatning ishqor bilan o'zaro ta'siri va bir xil tuzning temir bilan o'zaro ta'siri.
O'qituvchi. Bajarilgan reaksiyalar uchun molekulyar tenglamalarni yozing. Har bir tenglamada boshlang'ich moddalar va reaktsiya mahsulotlari formulalaridagi elementlarning oksidlanish darajalarini joylashtiring.
Talaba doskaga reaksiya tenglamalarini yozadi va oksidlanish darajalarini belgilaydi:
O'qituvchi. Bu reaksiyalarda elementlarning oksidlanish darajalari o'zgarganmi?
Talaba. Birinchi tenglamada elementlarning oksidlanish darajalari o'zgarmadi, lekin ikkinchisida ular o'zgardi - mis va temir uchun.
O'qituvchi. Ikkinchi reaksiya oksidlanish-qaytarilish reaksiyasidir. Oksidlanish-qaytarilish reaksiyalarini aniqlashga harakat qiling.
Talaba. Reaksiyaga kirishuvchi moddalar va reaksiya mahsulotlarini tashkil etuvchi elementlarning oksidlanish darajalari o‘zgarishiga olib keladigan reaksiyalar oksidlanish-qaytarilish reaksiyalari deyiladi.
O`quvchilar o`qituvchining diktanti bo`yicha daftarlariga oksidlanish-qaytarilish reaksiyalarining ta`rifini yozadilar.
O'qituvchi. Oksidlanish-qaytarilish reaktsiyasi natijasida nima sodir bo'ldi? Reaksiyadan oldin temirning oksidlanish darajasi 0 ga teng edi, reaktsiyadan keyin u +2 ga aylandi. Ko'rib turganimizdek, oksidlanish darajasi oshdi, shuning uchun temir 2 ta elektronni beradi.
Misning oksidlanish darajasi reaksiyaga qadar +2 ga, reaksiyadan keyin esa 0 ga teng, oksidlanish darajasi pasaygan. Shuning uchun mis 2 ta elektronni qabul qiladi.
Temir elektronlarni beradi, u qaytaruvchi vositadir va elektronlarni uzatish jarayoni oksidlanish deb ataladi.
Mis elektronlarni qabul qiladi, u oksidlovchi vositadir va elektronlarni qo'shish jarayoni qaytarilish deb ataladi.
Keling, ushbu jarayonlarning diagrammalarini yozamiz:
Shunday qilib, "qaytaruvchi vosita" va "oksidlovchi agent" tushunchalariga ta'rif bering.
Talaba. Elektron beradigan atomlar, molekulalar yoki ionlar qaytaruvchi moddalar deb ataladi.
Elektron oladigan atomlar, molekulalar yoki ionlar oksidlovchi moddalar deb ataladi.
O'qituvchi. Qaytarilish va oksidlanish jarayonlarini qanday aniqlashimiz mumkin?
Talaba. Qaytarilish atom, molekula yoki ionning elektron olish jarayonidir.
Oksidlanish - atom, molekula yoki ion tomonidan elektronlarni uzatish jarayoni.
O‘quvchilar diktantdan ta’riflarni daftarga yozib, chizadilar.
Eslab qoling!
Elektronlarni bering va oksidlang.
Elektronlarni oling - tiklang.
O'qituvchi. Oksidlanish har doim qaytarilish bilan kechadi va aksincha, qaytarilish doimo oksidlanish bilan bog'liq. Qaytaruvchi tomonidan berilgan elektronlar soni oksidlovchi tomonidan olingan elektronlar soniga teng.
Oksidlanish-qaytarilish reaktsiyalari tenglamalarida koeffitsientlarni tanlash uchun ikkita usul qo'llaniladi - elektron balans va elektron-ion balansi (yarim reaksiya usuli).
Biz faqat elektron balans usulini ko'rib chiqamiz. Buning uchun elektron balans usuli yordamida koeffitsientlarni tartibga solish algoritmidan foydalanamiz (Watman qog'ozida ishlab chiqilgan).
MISOL Elektron balans usulidan foydalangan holda ushbu reaktsiya sxemasidagi koeffitsientlarni joylashtiring, oksidlovchi va qaytaruvchini aniqlang, oksidlanish va qaytarilish jarayonlarini ko'rsating:
Fe2O3 + CO Fe + CO2.
Elektron balans usuli yordamida koeffitsientlarni tartibga solish algoritmidan foydalanamiz.
3. Oksidlanish darajasini o‘zgartiruvchi elementlarni yozamiz:
4. Berilgan va qabul qilingan elektronlar sonini aniqlovchi elektron tenglamalar tuzamiz:
5. Berilgan va qabul qilingan elektronlar soni bir xil bo'lishi kerak, chunki Na boshlang'ich materiallar, na reaktsiya mahsulotlari zaryadlanmaydi. Biz berilgan va qabul qilingan elektronlar sonini eng kichik umumiy ko'p (LCM) va qo'shimcha omillarni tanlash orqali tenglashtiramiz:
6. Olingan ko'paytirgichlar koeffitsientlardir. Koeffitsientlarni reaksiya sxemasiga o'tkazamiz:
Fe2O3 + 3CO = 2Fe + 3CO2.
Ko'p reaktsiyalarda oksidlovchi yoki qaytaruvchi moddalar bo'lgan moddalar tipik deyiladi.
Whatman qog'oziga yasalgan stol osilgan.
O'qituvchi. Redoks reaktsiyalari juda keng tarqalgan. Ular nafaqat korroziya jarayonlari, balki tirik organizmda sodir bo'ladigan fermentatsiya, parchalanish, fotosintez va metabolik jarayonlar bilan ham bog'liq. Ular yoqilg'ining yonishi paytida kuzatilishi mumkin.
Kimyoviy tenglamani qanday muvozanatlash kerak: qoidalar va algoritm
Oksidlanish-qaytarilish jarayonlari tabiatdagi moddalarning aylanish jarayoniga hamroh bo'ladi.
Bilasizmi, har kuni atmosferada taxminan 2 million tonna nitrat kislota hosil bo'ladi, yoki
Yiliga 700 million tonna va yomg'ir bilan erga zaif eritma shaklida tushadi (odamlar yiliga atigi 30 million tonna nitrat kislota ishlab chiqaradi).
Atmosferada nima sodir bo'lmoqda?
Havoda 78% hajmli azot, 21% kislorod va 1% boshqa gazlar mavjud. Chaqmoq oqimlari ta'sirida va Yerda har soniyada o'rtacha 100 ta chaqmoq chaqadi, azot molekulalari kislorod molekulalari bilan o'zaro ta'sirlanib, azot oksidi (II) hosil qiladi:
Azot oksidi (II) atmosfera kislorodi bilan osongina azot oksidi (IV) ga oksidlanadi:
Olingan azot oksidi (IV) kislorod ishtirokida atmosfera namligi bilan reaksiyaga kirishib, nitrat kislotaga aylanadi:
NO2 + H2O + O2 HNO3.
Bu reaksiyalarning barchasi oksidlanish-qaytarilishdir.
Mashq qilish . Elektron balans usuli yordamida berilgan reaksiya sxemalarida koeffitsientlarni joylashtiring, oksidlovchi, qaytaruvchi, oksidlanish va qaytarilish jarayonlarini ko'rsating.
Yechim
1. Elementlarning oksidlanish darajalarini aniqlaymiz:
2. Oksidlanish darajalari o'zgargan elementlarning belgilarini ta'kidlaymiz:
3. Oksidlanish darajalarini o‘zgartirgan elementlarni yozamiz:
4. Elektron tenglamalar tuzamiz (berilgan va qabul qilingan elektronlar sonini aniqlang):
5. Berilgan va qabul qilingan elektronlar soni bir xil.
6. Elektron sxemalardan koeffitsientlarni reaksiya diagrammasiga o'tkazamiz:
Keyinchalik talabalarga elektron balans usuli yordamida koeffitsientlarni mustaqil tartibga solish, oksidlovchi, qaytaruvchini aniqlash, tabiatda sodir bo'ladigan boshqa jarayonlarda oksidlanish va qaytarilish jarayonlarini ko'rsatish taklif etiladi.
Boshqa ikkita reaksiya tenglamalari (koeffitsientlar bilan) quyidagi shaklga ega:
Vazifalarning to'g'riligi kodoskop yordamida tekshiriladi.
Yakuniy qism
O‘qituvchi o‘quvchilarga o‘rgangan materiali asosida krossvord yechishlarini so‘raydi. Ish natijasi tekshirish uchun taqdim etiladi.
Yechilgan Bosh qotirma, KMnO4, K2Cr2O7, O3 moddalarining kuchli ekanligini bilib olasiz... (vertikal (2)).
Gorizontal:
1. Diagramma qanday jarayonni aks ettiradi:
3. Reaksiya
N2 (g.) + 3H2 (g.) 2NH3 (g.) + Q
oksidlanish-qaytarilish, qaytar, bir hil, ....
4. ... uglerod (II) odatiy qaytaruvchidir.
5. Diagramma qanday jarayonni aks ettiradi:
6. Oksidlanish-qaytarilish reaksiyalari tenglamalarida koeffitsientlarni tanlash uchun elektron... usulidan foydalaning.
7. Diagrammaga ko'ra, alyuminiy ... elektrondan voz kechdi.
8. Reaksiyada:
H2 + Cl2 = 2HCl
vodorod H2 - ... .
9. Qaysi turdagi reaksiyalar har doim faqat oksidlanish-qaytarilishdir?
10. Oddiy moddalarning oksidlanish darajasi….
11. Reaksiyada:
kamaytiruvchi vosita -….
Uyga vazifa.
O.S.Gabrielyanning "Kimyo-8" darsligiga ko'ra, § 43, p. 178–179, misol. 1, 7 yozma. Vazifa (uy uchun). Birinchilarning dizaynerlari kosmik kemalar va suv osti kemalari muammoga duch kelishdi: kema va kosmik stantsiyalarda doimiy havo tarkibini qanday saqlash kerak? Ortiqcha karbonat angidriddan qutulib, kislorodni to'ldirasizmi? Yechim topildi.
Kaliy superoksid KO2 kislorod hosil qilish uchun karbonat angidrid bilan reaksiyaga kirishadi:
Ko'rib turganingizdek, bu redoks reaktsiyasi. Bu reaksiyadagi kislorod ham oksidlovchi, ham qaytaruvchi vositadir.
Kosmik missiyada har bir gramm yuk hisobga olinadi. Agar parvoz 10 kun davom etsa va ekipaj ikki kishidan iborat bo'lsa, kosmik parvozda olinishi kerak bo'lgan kaliy superoksid zaxirasini hisoblang. Ma'lumki, odam kuniga 1 kg karbonat angidridni chiqaradi.
(Javob: 64,5 kg KO2. )
Topshiriq (qiyinchilik darajasini oshirish). Rodos Kolossusining yo'q qilinishiga olib kelishi mumkin bo'lgan oksidlanish-qaytarilish reaktsiyalarining tenglamalarini yozing. Shuni yodda tutingki, bu ulkan haykal Egey dengizidagi orolda, O'rta er dengizining nam havosi tuzlar bilan to'ldirilgan zamonaviy Turkiya qirg'oqlari yaqinida joylashgan port shahrida joylashgan. U bronzadan (mis va qalay qotishmasi) yasalgan va temir ramkaga o'rnatilgan.
Adabiyot
Gabrielyan O.S.. Kimyo - 8. M.: Bustard, 2002;
Gabrielyan O.S., Voskoboynikova N.P., Yashukova A.V. O'qituvchi uchun qo'llanma. 8-sinf. M.: Bustard, 2002;
Koks R., Morris N. Dunyoning yetti mo'jizasi. Qadimgi dunyo, O'rta asrlar, bizning davrimiz. M.: BMM AO, 1997;
Kichik bolalar ensiklopediyasi. Kimyo. M.: Rossiya entsiklopedik hamkorligi, 2001; Bolalar uchun "Avanta+" ensiklopediyasi. Kimyo. T. 17. M.: Avanta+, 2001;
Xomchenko G.P., Sevastyanova K.I. Oksidlanish-qaytarilish reaksiyalari. M.: Ta'lim, 1989 yil.
S.P.Lebesheva,
8-sonli umumta’lim maktabi kimyo o‘qituvchisi
(Baltiysk, Kaliningrad viloyati)
Koeffitsientlarni tanlash qoidalari:
-agar reaksiya sxemasining bir qismidagi element atomlari soni juft, ikkinchi qismida toq bo'lsa, formula oldiga toq sonli atomlar bilan 2 koeffitsientini, keyin esa barchaning sonini qo'yish kerak. atomlarni tenglashtirish kerak.
— koeffitsientlarni joylashtirish tarkibidagi eng murakkab moddadan boshlanishi va buni quyidagi ketma-ketlikda bajarish kerak:
birinchi navbatda siz metall atomlari sonini tenglashtirishingiz kerak, keyin - kislota qoldiqlari (metall bo'lmagan atomlar), keyin vodorod atomlari va nihoyat - kislorod atomlari.
— tenglamaning chap va o‘ng tomonidagi kislorod atomlari soni bir xil bo‘lsa, koeffitsientlar to‘g‘ri aniqlanadi.
- bundan keyin tenglama qismlari orasidagi o'q teng belgisi bilan almashtirilishi mumkin.
— kimyoviy reaksiya tenglamasidagi koeffitsientlar umumiy bo‘luvchilarga ega bo‘lmasligi kerak.
Misol. Temir (III) gidroksid va sulfat kislota o‘rtasidagi kimyoviy reaksiya natijasida temir (III) sulfat hosil qilish tenglamasini tuzamiz.
1. Reaksiya diagrammasini tuzamiz:
Fe(OH)3 + H2SO4 → Fe2(SO4)3 + H2O
2. Moddalar formulalari uchun koeffitsientlarni tanlaylik. Biz bilamizki, biz eng murakkab moddadan boshlashimiz va butun sxema bo'ylab ketma-ket tenglashtirishimiz kerak, birinchi navbatda metall atomlari, keyin kislota qoldiqlari, keyin vodorod va nihoyat kislorod. Bizning sxemamizda eng murakkab modda Fe2(SO4)3 hisoblanadi. U ikkita temir atomini, Fe (OH) 3 esa bitta temir atomini o'z ichiga oladi. Bu shuni anglatadiki, Fe (OH) 3 formulasidan oldin siz 2 koeffitsientini qo'yishingiz kerak:
2Fe(OH)3 + H2SO4 → Fe2(SO4)3 + H2O
Endi SO4 ning kislotali qoldiqlari sonini tenglashtiramiz. Fe2(SO4)3 tuzi tarkibida uchta kislotali SO4 qoldiqlari mavjud. Bu shuni anglatadiki, H2SO4 formulasidan oldin chap tomonda biz 3 koeffitsientini qo'yamiz:
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + H2O.
Endi vodorod atomlari sonini tenglashtiramiz. Diagrammaning chap tomonida temir gidroksid 2Fe(OH)3 - 6 vodorod atomi (2)
· 3), sulfat kislota 3H2SO4da ham 6 ta vodorod atomi mavjud.
Kimyoviy tenglamalarda koeffitsientlarni joylashtirish
Chap tomonda jami 12 ta vodorod atomi mavjud. Bu shuni anglatadiki, o'ng tomonda biz H2O suv formulasi oldiga 6 koeffitsientini qo'yamiz va endi o'ng tomonda 12 ta vodorod atomi mavjud:
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O.
Kislorod atomlari sonini tenglashtirish qoladi. Ammo bu endi kerak emas, chunki diagrammaning chap va o'ng qismlarida allaqachon bir xil miqdordagi kislorod atomlari mavjud - har bir qismda 18 ta. Bu diagramma to'liq yozilganligini anglatadi va biz o'qni teng belgi bilan almashtirishimiz mumkin:
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O.
Ta'lim
Kimyoviy tenglamalarda koeffitsientlar qanday joylashtiriladi? Kimyoviy tenglamalar
Bugun biz kimyoviy tenglamalarda koeffitsientlarni qanday joylashtirish haqida gaplashamiz. Bu savol nafaqat umumta'lim muassasalarining o'rta maktab o'quvchilarini, balki murakkab va qiziqarli fanning asosiy elementlari bilan endigina tanishayotgan bolalarni ham qiziqtiradi. Agar siz birinchi bosqichda kimyoviy tenglamalarni qanday yozishni tushunsangiz, kelajakda muammolarni hal qilishda muammolarga duch kelmaysiz. Keling, buni boshidanoq aniqlaylik.
Tenglama nima
Odatda tanlangan reagentlar o'rtasida sodir bo'ladigan kimyoviy reaktsiyaning an'anaviy qayd etilishi tushuniladi. Bunday jarayon uchun indekslar, koeffitsientlar va formulalar qo'llaniladi.
Kompilyatsiya algoritmi
Kimyoviy tenglamalar qanday yoziladi? Har qanday o'zaro ta'sirlarga misollar asl bog'lanishlarni jamlash orqali yozilishi mumkin. Tenglik belgisi reaksiyaga kirishuvchi moddalar o'rtasida o'zaro ta'sir sodir bo'lishini ko'rsatadi. Keyinchalik, mahsulotlarning formulasi valentlik (oksidlanish darajasi) bo'yicha tuziladi.
Mavzu bo'yicha video
Reaktsiyani qanday yozish kerak
Misol uchun, agar siz metanning xususiyatlarini tasdiqlovchi kimyoviy tenglamalarni yozishingiz kerak bo'lsa, quyidagi variantlarni tanlang:
- galogenlanish (VIIA elementi bilan radikal o'zaro ta'sir davriy jadval D. I. Mendeleev);
- havo kislorodida yonish.

Birinchi holda, biz chap tomonga boshlang'ich moddalarni, o'ng tomonga esa hosil bo'lgan mahsulotlarni yozamiz. Har bir kimyoviy elementning atomlari sonini tekshirgandan so'ng, biz davom etayotgan jarayonning yakuniy yozuvini olamiz. Metan havo kislorodida yonganda, ekzotermik jarayon sodir bo'ladi, buning natijasida karbonat angidrid va suv bug'lari.
Kimyoviy tenglamalarda koeffitsientlarni to'g'ri belgilash uchun moddalar massasining saqlanish qonunidan foydalaniladi. Biz tenglashtirish jarayonini uglerod atomlari sonini aniqlash orqali boshlaymiz. Keyinchalik, biz vodorod uchun hisob-kitoblarni amalga oshiramiz va shundan keyingina kislorod miqdorini tekshiramiz.
OVR
Murakkab kimyoviy tenglamalarni elektron muvozanat yoki yarim reaksiya usuli yordamida muvozanatlash mumkin. Biz quyidagi turdagi reaktsiyalarda koeffitsientlarni belgilash uchun mo'ljallangan harakatlar ketma-ketligini taklif qilamiz:

Birinchidan, birikmadagi har bir elementning oksidlanish darajalarini tartibga solish muhimdir. Ularni tashkil qilishda ba'zi qoidalarni hisobga olish kerak:
- Oddiy modda uchun u nolga teng.
- Ikkilik birikmada ularning yig'indisi 0 ga teng.
- Uch yoki undan ortiq elementlardan iborat birikmada birinchisi ijobiy qiymatga ega, eng tashqi ion - salbiy ma'no oksidlanish darajasi. Markaziy element jami 0 bo'lishi kerakligini hisobga olgan holda matematik tarzda hisoblanadi.
Keyinchalik, oksidlanish darajasi o'zgargan atomlar yoki ionlarni tanlang. Plyus va minus belgilari elektronlar sonini ko'rsatadi (qabul qilingan, berilgan). Keyinchalik, ular orasida eng kichik ko'paytma aniqlanadi. MOQni ushbu raqamlarga bo'lishda raqamlar olinadi. Ushbu algoritm kimyoviy tenglamalarda koeffitsientlarni qanday joylashtirish kerakligi haqidagi savolga javob bo'ladi.
Birinchi misol
Aytaylik, vazifa berildi: “Reaksiyadagi koeffitsientlarni joylashtiring, bo'sh joylarni to'ldiring, oksidlovchi va qaytaruvchini aniqlang.” Bunday misollar kimyoni Yagona davlat imtihoni sifatida tanlagan maktab bitiruvchilariga taklif etiladi.
KMnO4 + H2SO4 + KBr = MnSO4 + Br2 +…+…

Keling, kelajakdagi muhandislar va shifokorlarga taklif qilinadigan kimyoviy tenglamalarda koeffitsientlarni qanday joylashtirishni tushunishga harakat qilaylik. Boshlang'ich materiallar va mavjud mahsulotlarda elementlarning oksidlanish darajalarini tartibga solgandan so'ng, marganets ioni oksidlovchi, bromid ioni esa qaytaruvchi xususiyatga ega ekanligini aniqlaymiz.
Biz o'tkazib yuborilgan moddalar oksidlanish-qaytarilish jarayonida ishtirok etmaydi degan xulosaga keldik. Yo'qolgan mahsulotlardan biri suv, ikkinchisi esa kaliy sulfat bo'ladi. Elektron balansni tuzgandan so'ng, yakuniy bosqich tenglamadagi koeffitsientlarni o'rnatish bo'ladi.
Ikkinchi misol
Redoks tipidagi kimyoviy tenglamalarda koeffitsientlarni qanday joylashtirishni tushunish uchun yana bir misol keltiramiz.
Aytaylik, bizga quyidagi diagramma berilgan:
P + HNO3 = NO2 +…+…
Fosfor, ta'rifi bo'yicha oddiy modda bo'lib, oksidlanish darajasini +5 ga oshirib, qaytaruvchi xususiyatga ega. Shuning uchun etishmayotgan moddalardan biri fosforik kislota H3PO4 bo'ladi. ORR azot bo'ladigan qaytaruvchi vositaning mavjudligini nazarda tutadi. Azot oksidiga (4) aylanib, NO2 hosil qiladi

Ushbu reaksiyaga koeffitsientlarni qo'yish uchun biz elektron balans tuzamiz.
P0 5e = P+5 ni beradi
N+5 e = N+4 ni oladi
Buni oldin hisobga olgan holda azot kislotasi va azot oksidi (4) 5 koeffitsientga ega bo'lishi kerak, biz tayyor reaktsiyani olamiz:
P + 5HNO3 =5NO2 + H2O + H3PO4
Kimyodagi stereokimyoviy koeffitsientlar turli xil hisoblash masalalarini hal qilish imkonini beradi.
Uchinchi misol
Koeffitsientlarni joylashtirish ko'plab o'rta maktab o'quvchilari uchun qiyinchilik tug'dirishini hisobga olib, harakatlar ketma-ketligini mashq qilish kerak. aniq misollar. Biz topshiriqning yana bir misolini taklif qilamiz, uning bajarilishi oksidlanish-qaytarilish reaktsiyasida koeffitsientlarni tartibga solish metodologiyasini bilishni talab qiladi.
H2S + HMnO4 = S + MnO2 +…

Taklif etilayotgan vazifaning o'ziga xos xususiyati shundaki, etishmayotgan reaktsiya mahsulotini to'ldirish kerak va shundan keyingina koeffitsientlarni belgilashga o'tishimiz mumkin.
Birikmalardagi har bir elementning oksidlanish darajalarini tartibga solgandan so'ng, marganets oksidlovchi xususiyatga ega, uning valentligini pasaytiradi, degan xulosaga kelishimiz mumkin. Taklif etilayotgan reaktsiyada kamaytirish qobiliyati oltingugurt bilan namoyon bo'ladi, oddiy moddaga qaytariladi. Elektron balansni tuzgandan so'ng, biz qilishimiz kerak bo'lgan narsa taklif qilingan texnologik diagrammadagi koeffitsientlarni tartibga solishdir. Va bajarildi.
To'rtinchi misol
Kimyoviy tenglama unda moddalar massasining saqlanish qonuni to'liq bajarilganda to'liq jarayon deyiladi. Ushbu naqshni qanday tekshirish mumkin? Reaksiyaga kirgan bir xil turdagi atomlar soni ularning reaksiya mahsulotlaridagi soniga mos kelishi kerak. Faqat bu holatda yozilganlarning foydaliligi haqida gapirish mumkin bo'ladi kimyoviy o'zaro ta'sir, hisob-kitoblarni amalga oshirish, hisoblash masalalarini hal qilish uchun foydalanish imkoniyati turli darajalar qiyinchiliklar. Reaksiyada etishmayotgan stereokimyoviy koeffitsientlarni joylashtirishni o'z ichiga olgan vazifaning bir varianti:
Si + …+ HF = H2SiF6 + NO +…

Vazifaning qiyinligi shundaki, boshlang'ich moddalar ham, reaktsiya mahsulotlari ham yo'q. Barcha elementlarning oksidlanish darajalarini o'rnatgandan so'ng, biz taklif qilingan vazifadagi kremniy atomining qaytaruvchi xususiyatga ega ekanligini ko'ramiz. Reaksiya mahsulotlari orasida azot (II) mavjud bo'lib, boshlang'ich birikmalardan biri nitrat kislotadir; Reaksiyaning etishmayotgan mahsuloti suv ekanligini mantiqan aniqlaymiz. Yakuniy bosqich natijada olingan stereokimyoviy koeffitsientlarni reaktsiyaga joylashtirish bo'ladi.
3Si + 4HNO3 + 18HF = 3H2SiF6 + 4NO + 8 H2O
Tenglama masalasiga misol
Uning karbidini gidrolizlash jarayonida hosil bo'lgan kaltsiy gidroksidni to'liq neytrallash uchun zarur bo'lgan zichligi 1,05 g / ml bo'lgan 10% li vodorod xlorid eritmasining hajmini aniqlash kerak. Ma'lumki, gidroliz paytida chiqarilgan gaz 8,96 litr hajmni egallaydi (n.s.) Vazifani bajarish uchun siz avval kaltsiy karbidining gidroliz jarayoni uchun tenglamani yaratishingiz kerak:
CaC2 + 2H2O = Ca (OH)2 + C2H2
Kaltsiy gidroksidi vodorod xlorid bilan reaksiyaga kirishadi va to'liq neytrallanish sodir bo'ladi:
Ca(OH)2 + 2HCl = CaCl2 + 2H2O

Ushbu jarayon uchun kerak bo'ladigan kislota massasini hisoblaymiz.
Kimyoviy tenglamalardagi koeffitsientlar va indekslar
Vodorod xlorid eritmasining hajmini aniqlang. Muammo uchun barcha hisob-kitoblar stereokimyoviy koeffitsientlarni hisobga olgan holda amalga oshiriladi, bu ularning ahamiyatini tasdiqlaydi.
Nihoyat
Kimyo fanidan yagona davlat imtihonining natijalari tahlili shuni ko'rsatadiki, tenglamalarda stereokimyoviy koeffitsientlarni o'rnatish, elektron balansni tuzish, oksidlovchi va qaytaruvchi vositani aniqlash bilan bog'liq vazifalar umumta'lim maktablarining zamonaviy bitiruvchilari uchun jiddiy qiyinchiliklar tug'dirmoqda. Afsuski, zamonaviy bitiruvchilarning mustaqillik darajasi deyarli minimal, shuning uchun o'rta maktab o'quvchilari o'qituvchi tomonidan taklif qilingan nazariy asoslarni amalda qo'llamaydilar.
Orasida tipik xatolar, maktab o'quvchilari reaktsiyalarda koeffitsientlarni tartibga solishda qanday taxmin qilishadi har xil turlari, ko'plab matematik xatolar. Misol uchun, hamma ham eng kichik umumiy ko'p sonni qanday topishni yoki raqamlarni to'g'ri bo'lish va ko'paytirishni bilmaydi. Ushbu hodisaning sababi ta'lim maktablarida ushbu mavzuni o'rganish uchun ajratilgan soatlar sonining kamayishi hisoblanadi. Da asosiy dastur kimyoda o'qituvchilar o'z talabalari bilan oksidlanish-qaytarilish jarayonida elektron balansni tayyorlash bilan bog'liq masalalarda ishlash imkoniyatiga ega emaslar.
Ta'lim
Kvadrat nima? Kvadratning uchlari, kesmasi, tekisligi, tenglamasi, hajmi, asos maydoni va burchagi qanday topiladi?
Kvadrat nima degan savolga ko'p javoblar bo'lishi mumkin. Hammasi bu savolni kimga berganingizga bog'liq. Musiqachi kvadrat 4, 8, 16, 32 bar yoki jazz improvizatsiyasi ekanligini aytadi. Bola - bu nima ...
Avtomobillar
Avtomobilda antifrizni qanchalik tez-tez almashtirish kerak?
Avtomobil dvigateli ishlayotganida uning silindrlari ichidagi gazlarning harorati 2000 darajaga etadi. Shu sababli, qismlar juda qizib ketadi. quvvat bloki. Dvigateldan ortiqcha issiqlikni olib tashlash uchun ...
Avtomobillar
Avtomobilda termostat qanday ishlaydi? Ishlash printsipi
Hech qaysi zamonaviy avtomobil sovutish tizimisiz qilolmaydi. Yonuvchan aralashmani qayta ishlashda dvigateldan chiqadigan barcha issiqlikni u o'z zimmasiga oladi. Pistonlar harakatlanadi, aralashma yonadi, shuning uchun sizga yaxshi...
Avtomobillar
O'z qo'lingiz bilan mashinada konditsionerni qanday zaryad qilish kerak? Avtomobilingizning konditsionerini qanchalik tez-tez to'ldirishingiz kerak? Avtomobilimdagi konditsionerni qayerda to'ldirishim mumkin?
Bugungi kunda avtomobil konditsioneri nafaqat hashamat, balki salonda qulay mikroiqlim uchun javobgar bo'lgan avtomobil uchun zarur qurilma. Deyarli hamma narsa zamonaviy modellar avtomobillar jihozlangan, agar iqlim nazorati bo'lmasa ...
Avtomobillar
O'z qo'lingiz bilan mashinada konditsionerni qanday tozalash kerak?
Avtomobil egalari doimo o'z transport vositalarining asosiy qismlari va mexanizmlarining holati haqida g'amxo'rlik qilishlari kerak. Axir, ularni toza va yaxshi holatda saqlash optimal darajadagi xavfsizlikni olish imkonini beradi...
Avtomobillar
Transmissiya moyi 80W90: xususiyatlari, tanlash, sharhlar. Qo'lda uzatma qutisiga qanday moy qo'yish kerak?
Xususiyatlari bugun ko'rib chiqiladigan transmissiya moyi 80W90, 85W90 va 75W90 yopishqoqlik sinflari orasida o'rtacha deb tasniflanishi mumkin. Keling, bir-biridan qanday sifat jihatidan farq qilishini batafsilroq bilib olaylik...
Avtomobillar
Rulda kuchaytirgichiga qanday moy qo'yishim kerak? Rulda kuchaytirgich moyini almashtirish bo'yicha maslahatlar
Rulda kuchaytirgichi, avtomobilning boshqa komponentlari va agregatlari kabi, davriy texnik xizmat ko'rsatishni talab qiladi. Ko'pincha, barcha profilaktika choralari ishchi suyuqlikni almashtirishga to'g'ri keladi. Ko'pincha sizga kerak ...
Avtomobillar
Moskvada to'xtash joyi uchun qanday to'lash kerak? Pullik to'xtash qoidalari
Moskva avtoulovchilarining hayotini ancha osonlashtirish uchun pullik to'xtash qoidalari yaratilgan. Nima to'xtash kerakligi sir emas transport vositasi Poytaxtda bu unchalik oson emas: shahar yo‘llari mashinalar bilan gavjum...
Avtomobillar
O'z qo'lingiz bilan avtomobil lazzatlarini qanday qilish kerak
Har bir avtomobil egasi o'zining temir otining ichki qismida yoqimli va sevimli hid doimo bo'lishini xohlaydi. Kimdir qahva hidini, kimdir sitrusni, yana kimdir yangilikni yoqtiradi. Qanday xushbo'y moddalar ...
Avtomobillar
Uyda batareyani qanday zaryad qilish kerak?
Ehtimol, har bir avtomobil egasi o'lik batareya muammosiga duch kelgan. Agar siz mashinaning quvvat manbaiga etarlicha e'tibor bermasangiz, bu muammo har qanday haydovchi bilan sodir bo'lishi mumkin ...
VARIANT 1
a) Na + O2 -> Na2O d) H2 + F2 -> HF
b) CaCO3-> CaO + CO2 e) H2O + K2O -> KOH
c) Zn + H2SO4 -> H2 + ZnSO4 e) Cu(OH)2 + HNO3 -> Cu(NO3)2 + H2O
13-dars. Kimyoviy tenglamalarni yozish
Ta'riflarni yozing:
a) birikma reaksiya b) ekzotermik reaksiya c) qaytmas reaksiya.
a) uglerod kislorod bilan reaksiyaga kirishadi va uglerod oksidi (II) hosil bo'ladi;
b) magniy oksidi nitrat kislota va magniy nitrat bilan reaksiyaga kirishib, suv hosil bo'ladi;
v) temir (III) gidroksid temir (III) oksidi va suvga parchalanadi;
d) metan CH4 kislorodda yonib, uglerod oksidi (IV) va suv hosil qiladi;
e) azot oksidi (V) suvda eriganda nitrat kislota hosil qiladi.
4. Masalani tenglama yordamida yeching:
a) Vodorod ftor bilan reaksiyaga kirishganda qanday hajmdagi vodorod ftorid hosil bo'ladi?
b) Tarkibida 80% CaCO3 boʻlgan ohaktosh parchalanganda qanday massa kalsiy oksidi hosil boʻladi?
v) Tarkibida 35% aralashmalar bo‘lgan rux sulfat kislota bilan reaksiyaga kirishganda vodorodning qanday hajm va massasi ajralib chiqadi?
VARIANT 2
- Koeffitsientlarni joylashtiring, kimyoviy reaksiya turini aniqlang, formulalar ostidagi moddalarning nomlarini yozing:
a) P + O2 -> P2O5 d) H2 + N2 -> NH3
b) CaCO3 + HCl -> CaCl2 + H2O + CO2 e) H2O + Li2O -> LiOH
c) Mg + H2SO4 -> H2 + Mg SO4 e) Ca(OH)2 + HNO3 -> Ca(NO3)2 + H2O
2. Ta'riflarni yozing:
a) parchalanish reaksiyasi b) endotermik reaksiya c) katalitik reaksiya.
3. Tenglamalarni tasvirlanganidek yozing:
a) uglerod kislorod bilan reaksiyaga kirishadi va uglerod oksidi (IV) hosil bo'ladi;
b) bariy oksidi nitrat kislota va bariy nitrat bilan reaksiyaga kirishib, suv hosil bo‘ladi;
v) alyuminiy gidroksid alyuminiy oksidi va suvga parchalanadi;
d) ammiak NH3 kislorod va azotda yonadi va suv hosil bo'ladi;
e) fosfor (V) oksidi suvda eritilganda fosfor kislotasini hosil qiladi.
4. Masalani tenglama yordamida yeching:
a) Vodorod azot bilan reaksiyaga kirishganda qancha hajmdagi ammiak hosil bo'ladi?
b) Tarkibida 80% CaCO3 bo‘lgan marmar xlorid kislota bilan reaksiyaga kirishganda kalsiy xloridning qanday massasi hosil bo‘ladi?
v) Tarkibida 30% aralashmalar bo‘lgan magniy sulfat kislota bilan reaksiyaga kirishganda vodorodning qanday hajm va massasi ajralib chiqadi?
 Kimyoviy tenglamalar qanday yoziladi? Birinchidan, birikmadagi har bir elementning oksidlanish darajalarini tartibga solish muhimdir. Aytaylik, vazifa berildi: “Reaksiyadagi koeffitsientlarni joylashtiring, bo'sh joylarni to'ldiring, oksidlovchi va qaytaruvchini aniqlang.” Yo'qolgan mahsulotlardan biri suv, ikkinchisi esa kaliy sulfat bo'ladi. Elektron balansni tuzgandan so'ng, yakuniy bosqich tenglamadagi koeffitsientlarni o'rnatish bo'ladi. Muammo uchun barcha hisob-kitoblar stereokimyoviy koeffitsientlarni hisobga olgan holda amalga oshiriladi, bu ularning ahamiyatini tasdiqlaydi. Har xil turdagi reaktsiyalarda koeffitsientlarni tartibga solishda maktab o'quvchilari qiladigan odatiy xatolar orasida ko'plab matematik xatolar mavjud.
Kimyoviy tenglamalar qanday yoziladi? Birinchidan, birikmadagi har bir elementning oksidlanish darajalarini tartibga solish muhimdir. Aytaylik, vazifa berildi: “Reaksiyadagi koeffitsientlarni joylashtiring, bo'sh joylarni to'ldiring, oksidlovchi va qaytaruvchini aniqlang.” Yo'qolgan mahsulotlardan biri suv, ikkinchisi esa kaliy sulfat bo'ladi. Elektron balansni tuzgandan so'ng, yakuniy bosqich tenglamadagi koeffitsientlarni o'rnatish bo'ladi. Muammo uchun barcha hisob-kitoblar stereokimyoviy koeffitsientlarni hisobga olgan holda amalga oshiriladi, bu ularning ahamiyatini tasdiqlaydi. Har xil turdagi reaktsiyalarda koeffitsientlarni tartibga solishda maktab o'quvchilari qiladigan odatiy xatolar orasida ko'plab matematik xatolar mavjud.
Har bir element uchun ularni aniqlash mumkin bo'lgan muayyan qoidalar mavjud. Uch elementdan iborat formulalar oksidlanish darajasini hisoblashda o'z nuanslariga ega. Elektron balans usuli yordamida kimyoviy tenglamalarni qanday tenglashtirish haqida suhbatni davom ettiramiz. Majburiy shart chap va o'ng tarafdagi har bir elementning miqdorini tekshirishdir. Agar koeffitsientlar to'g'ri joylashtirilgan bo'lsa, ularning soni bir xil bo'lishi kerak.
Algebraik usul
Empirik formulalar va kimyoviy tahlillarni chuqur o'rganish uchun elementar tahlil haqida o'qing.
Kimyo moddalar, ularning xossalari va o'zgarishlarini o'rganadi. Molekulyar shaklda temirning atmosferada yonish jarayonini belgilar va belgilar yordamida ifodalash mumkin. Moddalarning massasini saqlash qonuniga ko'ra, mahsulot formulasi oldiga 2 koeffitsienti qo'yilishi kerak Keyinchalik, kaltsiy tekshiriladi. Boshlash uchun biz boshlang'ich moddalar va reaktsiya mahsulotlaridagi elementlarning har biri uchun oksidlanish darajasini belgilaymiz. Keyinchalik, vodorod sinovdan o'tkaziladi.
Kimyoviy reaksiyalarni tenglashtirish
Oddiy kimyoviy tenglamadan to'liq reaktsiyani olish uchun kimyoviy reaktsiyalarni tenglashtirish kerak. Keling, ugleroddan boshlaylik.
Massaning saqlanish qonuni kimyoviy reaksiya jarayonida yangi atomlarning paydo bo'lishini va eskilarini yo'q qilishni istisno qiladi. Har bir atomning indeksiga e'tibor bering, bu ularning sonini ko'rsatadi. Tenglamaning o'ng tomonidagi moddalar molekulalari oldiga pastki belgilarni qo'shish orqali biz kislorod atomlari sonini ham o'zgartirdik. Endi barcha uglerod, vodorod va kislorod atomlarining soni tenglamaning ikkala tomonida ham bir xil.
Ularning aytishicha, agar qavslar orqasida omil bo'lsa, unda qavsdagi har bir element unga ko'paytiriladi. Siz azotdan boshlashingiz kerak, chunki u kislorod va vodoroddan kamroq. Ajoyib, vodorod tenglashtirildi. Keyingi o'rin - bariy. U tenglashtirildi, unga teginishingiz shart emas. Reaksiyadan oldin ikkita xlor bor, undan keyin faqat bitta. Nima qilish kerak? Endi, hozirgina o'rnatilgan koeffitsient tufayli, reaktsiyadan so'ng biz ikkita natriy oldik va reaktsiyadan oldin biz ham ikkita natriy oldik. Ajoyib, qolgan hamma narsa tenglashtirildi. Keyingi qadam oksidlanish qayerda va qayerda qaytarilish sodir bo'lganligini tushunish uchun har bir moddadagi barcha elementlarning oksidlanish darajalarini tartibga solishdir.

Oddiy reaksiyalar tahliliga misol
O'ng tomonda indekslar yo'q, ya'ni kislorodning bir zarrasi, chap tomonda esa 2 ta zarracha mavjud. Hech qanday qo'shimcha indekslar yoki tuzatishlar yo'q kimyoviy formula Siz uni kirita olmaysiz, chunki u to'g'ri yozilgan. O'ng tomonda biz u erda 2 ta kislorod ionini olish uchun 2 ga ko'paytiramiz.
Vazifani o'zi boshlashdan oldin, kimyoviy element yoki butun formula oldiga qo'yilgan raqam koeffitsient deb ataladiganligini tushunishingiz kerak. Keling, tahlil qilishni boshlaylik. Shunday qilib, natijada tenglik belgisidan oldin va keyin har bir elementning atomlari soni bir xil bo'ladi. Shuni yodda tutingki, koeffitsient indeks bilan ko'paytiriladi va qo'shilmaydi.
Sizga quyidagi shartlarga rioya qilgan holda har qanday hujjatdan o'z maqsadlaringiz uchun erkin foydalanishga ruxsat beriladi:
2) Kimyoviy elementlarning belgilari davriy jadvalda qanday shaklda bo'lsa, qat'iy ravishda yozilishi kerak.
Ma'lumot kartasi. “Kimyoviy reaksiya tenglamalarida koeffitsientlarni joylashtirish algoritmi”.
3) Vaqti-vaqti bilan reaksiyaga kirishuvchi moddalar va mahsulotlarning formulalari mutlaqo to'g'ri yozilgan, ammo koeffitsientlar hali ham belgilanmagan holatlar yuzaga keladi. Bunday muammoning eng ko'p paydo bo'lishi uglerod skeleti yirtilgan organik moddalarning oksidlanish reaktsiyalari bilan bog'liq.
Siz nafaqat reaksiya tenglamasini yozishni, balki uni o'qishni ham bilishingiz kerak. Shuning uchun, ba'zida reaktsiya tenglamasidagi barcha formulalarni yozgandan so'ng, tenglamaning har bir qismidagi atomlar sonini tenglashtirish va koeffitsientlarni o'rnatish kerak. Tenglamaning chap va o'ng tomonlarida har bir elementning atomlari soni teng yoki yo'qligini hisoblang.
Ko'pgina maktab o'quvchilari uchun kimyoviy reaktsiyalar tenglamalarini yozish va koeffitsientlarni to'g'ri joylashtirish oson ish emas. Lekin siz faqat bir nechtasini eslab qolishingiz kerak oddiy qoidalar, va vazifa endi qiyinchiliklarga olib kelmaydi. Koeffitsient, ya'ni molekula formulasi oldidagi son kimyoviy modda, barcha belgilar uchun amal qiladi va har bir belgining har bir indeksiga ko'paytiriladi!
13-darsda "" Kursdan " Dummies uchun kimyo» kimyoviy tenglamalar nima uchun kerakligini ko'rib chiqing; bilan kimyoviy reaksiyalarni tenglashtirishni o'rganamiz to'g'ri joylashtirish koeffitsientlar Bu dars oldingi darslardan asosiy kimyoni bilishni talab qiladi. Empirik formulalar va kimyoviy tahlillarni chuqur o'rganish uchun elementar tahlil haqida o'qing.
Metan CH 4 ning kislorod O 2 dagi yonish reaktsiyasi natijasida karbonat angidrid CO 2 va suv H 2 O hosil bo'ladi kimyoviy tenglama:
- CH 4 + O 2 → CO 2 + H 2 O (1)
Keling, kimyoviy tenglamadan shunchaki ko'rsatkichdan ko'ra ko'proq ma'lumot olishga harakat qilaylik mahsulotlar va reagentlar reaktsiyalar. Kimyoviy tenglama (1) to'liq emas va shuning uchun 1 CH 4 molekulasiga qancha O 2 molekulasi sarflanishi va buning natijasida qancha CO 2 va H2 O molekulalari olinishi haqida hech qanday ma'lumot berilmaydi. Ammo agar siz mos keladiganidan oldin yozsangiz molekulyar formulalar Reaksiyada har bir turdagi qancha molekula ishtirok etishini ko'rsatadigan raqamli koeffitsientlar, keyin biz olamiz to'liq kimyoviy tenglama reaktsiyalar.
Kimyoviy tenglamaning (1) tarkibini to'ldirish uchun siz bitta oddiy qoidani eslab qolishingiz kerak: tenglamaning chap va o'ng tomonlarida har bir turdagi atomlarning bir xil soni bo'lishi kerak, chunki kimyoviy reaktsiya paytida yangi atomlar bo'lmaydi. yaratilgan va mavjudlari yo'q qilinmaydi. Bu qoida biz bobning boshida muhokama qilgan massaning saqlanish qonuniga asoslanadi.
Bu oddiy kimyoviy tenglamadan to'liq tenglamani olish uchun kerak. Shunday qilib, keling, reaktsiyaning haqiqiy tenglamasiga (1) o'taylik: kimyoviy tenglamaga, aynan o'ng va chap tomonlardagi atomlar va molekulalarga yana bir nazar tashlang. Reaksiyada uch turdagi atomlar ishtirok etishini ko‘rish oson: uglerod C, vodorod H va kislorod O. Kimyoviy tenglamaning o‘ng va chap tomonidagi har bir turdagi atomlar sonini sanab, solishtiramiz.

Keling, ugleroddan boshlaylik. Chap tomonda bitta C atomi CH 4 molekulasining bir qismi, o'ng tomonda esa bitta C atomi CO 2 ning bir qismidir. Shunday qilib, chap va o'ng tomonlarda uglerod atomlarining soni bir xil, shuning uchun biz uni yolg'iz qoldiramiz. Aniqlik uchun uglerodli molekulalar oldiga 1 koeffitsientini qo'yaylik, garchi bu shart emas:
- 1CH 4 + O 2 → 1CO 2 + H 2 O (2)
Keyin vodorod atomlarini hisoblashga o'tamiz H. Chap tomonda CH 4 molekulasida 4 ta H atomi (miqdoriy ma'noda H 4 = 4H), o'ng tomonda esa faqat 2 H atomi mavjud. H 2 O molekulasi, bu kimyoviy tenglamaning chap tomonidagidan ikki baravar kam (2). Keling, tenglashamiz! Buni amalga oshirish uchun H 2 O molekulasi oldiga 2 koeffitsientini qo'yaylik.
- 1CH 4 + O 2 → 1CO 2 + 2H 2 O (3)
E'tibor bering, vodorod H ni tenglashtirish uchun suv molekulasi H 2 O oldiga yozgan 2 koeffitsienti uning tarkibiga kiradigan barcha atomlardan 2 barobar ortadi, ya'ni 2H 2 O 4H va 2O ni bildiradi. Mayli, biz buni hal qildik, qolgan narsa O dagi kislorod atomlari sonini hisoblash va solishtirish. kimyoviy tenglama(3). Chap tomonda O atomlari o'ngga qaraganda roppa-rosa 2 baravar kam ekanligi darhol e'tiboringizni tortadi. Endi siz kimyoviy tenglamalarni qanday muvozanatlashni bilasiz, shuning uchun men darhol yakuniy natijani yozaman:
- 1CH 4 + 2O 2 → 1CO 2 + 2H 2 O yoki CH 4 + 2O 2 → CO 2 + 2H 2 O (4)
Ko'rib turganingizdek, kimyoviy reaktsiyalarni tenglashtirish unchalik qiyin narsa emas va bu erda kimyo emas, balki matematika muhim ahamiyatga ega. (4) tenglama deyiladi to'liq tenglama kimyoviy reaktsiya, chunki u massa saqlanish qonuniga bo'ysunadi, ya'ni. reaksiyaga kiradigan har bir turdagi atomlar soni reaksiya tugagandan so'ng ushbu turdagi atomlar soniga to'g'ri keladi. Ushbu to'liq kimyoviy tenglamaning har bir tomonida 1 ta uglerod atomi, 4 ta vodorod atomi va 4 ta kislorod atomi mavjud. Biroq, er-xotinni tushunishga arziydi muhim nuqtalar: kimyoviy reaksiya alohida oraliq bosqichlarning murakkab ketma-ketligidir va shuning uchun, masalan, (4) tenglamani 1 metan molekulasi bir vaqtning o'zida 2 kislorod molekulasi bilan to'qnashishi kerak degan ma'noda izohlash mumkin emas. Reaksiya mahsulotlarini hosil qilish jarayonida sodir bo'ladigan jarayonlar ancha murakkab. Ikkinchi nuqta: to'liq tenglama reaksiya bizga uning molekulyar mexanizmi, ya'ni sodir bo'ladigan hodisalar ketma-ketligi haqida hech narsa aytmaydi molekulyar daraja uning kursi davomida.
Kimyoviy reaksiya tenglamalarida koeffitsientlar
Yana bitta aniq misol uni qanday qilib to'g'ri joylashtirish kerak imkoniyatlar kimyoviy reaksiya tenglamalarida: Trinitrotoluol (TNT) C 7 H 5 N 3 O 6 kislorod bilan kuchli birikib H 2 O, CO 2 va N 2 ni hosil qiladi. Tenglashadigan reaksiya tenglamasini yozamiz:
- C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (5)
Ikki TNT molekulasi asosida to'liq tenglamani tuzish osonroq, chunki chap tomonda toq sonli vodorod va azot atomlari, o'ng tomonda esa juft son mavjud:
- 2C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (6)
Keyin 14 ta uglerod atomi, 10 ta vodorod atomi va 6 ta azot atomi 14 molekula karbonat angidrid, 5 molekula suv va 3 molekula azotga aylanishi aniq bo'ladi:
- 2C 7 H 5 N 3 O 6 + O 2 → 14CO 2 + 5H 2 O + 3N 2 (7)
Endi ikkala qism ham kisloroddan tashqari barcha atomlarning bir xil sonini o'z ichiga oladi. Tenglamaning o'ng tomonida joylashgan 33 ta kislorod atomidan 12 tasi ikkita TNT molekulasi tomonidan, qolgan 21 tasi esa 10,5 O 2 molekulasi tomonidan ta'minlanishi kerak. Shunday qilib, to'liq kimyoviy tenglama quyidagicha ko'rinadi:
- 2C 7 H 5 N 3 O 6 + 10,5O 2 → 14CO 2 + 5H 2 O + 3N 2 (8)
Siz ikkala tomonni 2 ga ko'paytirasiz va butun bo'lmagan koeffitsient 10,5 dan xalos bo'lishingiz mumkin:
- 4C 7 H 5 N 3 O 6 + 21O 2 → 28CO 2 + 10H 2 O + 6N 2 (9)
Ammo buni qilish shart emas, chunki tenglamaning barcha koeffitsientlari butun son bo'lishi shart emas. Bitta TNT molekulasi asosida tenglama tuzish yanada to'g'ri bo'ladi:
- C 7 H 5 N 3 O 6 + 5,25O 2 → 7CO 2 + 2,5H 2 O + 1,5N 2 (10)
To'liq kimyoviy tenglama (9) juda ko'p ma'lumotlarni o'z ichiga oladi. Avvalo, bu boshlang'ich moddalarni ko'rsatadi - reaktivlar, shuningdek mahsulotlar reaktsiyalar. Bundan tashqari, bu reaktsiya davomida har bir turdagi barcha atomlar alohida saqlanib qolganligini ko'rsatadi. Agar (9) tenglamaning ikkala tomonini Avogadro soniga ko‘paytirsak, 4 mol trotil 21 mol O 2 bilan reaksiyaga kirishib, 28 mol CO 2, 10 mol H 2 O va 6 hosil bo‘lishini aytishimiz mumkin. N 2 mollari.
Yana bitta hiyla bor. Davriy jadval yordamida aniqlaymiz molekulyar og'irliklar bu moddalarning barchasi:
- C 7 H 5 N 3 O 6 = 227,13 g / mol
- O2 = 31,999 g/mol
- CO2 = 44,010 g/mol
- H2O = 18,015 g/mol
- N2 = 28,013 g/mol
Endi 9-tenglama ham shuni ko'rsatadiki, 4 227,13 g = 908,52 g TNT reaksiyani yakunlash uchun 21 31,999 g = 671,98 g kislorod kerak bo'ladi va natijada 28 44,010 g = 1232,3 g CO 2 hosil bo'ladi, 101 g = 101.8. g H2O va 6 · 28,013 g = 168,08 g N2. Bu reaksiyada massaning saqlanish qonuni bajariladimi yoki yo‘qligini tekshirib ko‘ramiz:
| Reaktivlar | Mahsulotlar | |
| 908,52 g TNT | 1232,3 g CO2 | |
| 671,98 g CO2 | 180,15 g H2O | |
| 168,08 g N2 | ||
| Jami | 1580,5 gr | 1580,5 gr |
Ammo alohida molekulalar kimyoviy reaksiyada qatnashishi shart emas. Masalan, ohaktosh CaCO3 reaktsiyasi va xlorid kislotasi HCl, kaltsiy xlorid CaCl2 va karbonat angidrid CO2 ning suvli eritmasini hosil qilish uchun:
- CaCO 3 + 2HCl → CaCl 2 + CO 2 + H 2 O (11)
Kimyoviy tenglama (11) kaltsiy karbonat CaCO 3 (ohaktosh) va xlorid kislota HCl ning kaltsiy xlorid CaCl 2 va karbonat angidrid CO 2 ning suvli eritmasini hosil qilish reaktsiyasini tavsiflaydi. Bu tenglama to'liq, chunki uning chap va o'ng tomonidagi har bir turdagi atomlar soni bir xil.
Ushbu tenglamaning ma'nosi makroskopik (molyar) daraja quyidagicha: 1 mol yoki 100,09 g CaCO 3 reaksiyani yakunlash uchun 2 mol yoki 72,92 g HCl ni talab qiladi, natijada 1 mol CaCl 2 (110,99 g/mol), CO 2 (44,01 g/mol) va H 2 hosil bo‘ladi. O (18,02 g/mol). Ushbu raqamli ma'lumotlardan bu reaktsiyada massa saqlanish qonuni bajarilishini tekshirish oson.
(11) tenglamani talqin qilish mikroskopik (molekulyar) daraja unchalik ravshan emas, chunki kaltsiy karbonat molekulyar birikma emas, tuzdir, shuning uchun (11) kimyoviy tenglamani 1 molekula kaltsiy karbonat CaCO 3 2 molekula HCl bilan reaksiyaga kirishishi ma'nosida tushunib bo'lmaydi. Bundan tashqari, eritmadagi HCl molekulasi odatda H + va Cl - ionlariga ajraladi (parchalanadi). Shunday qilib, ko'proq to'g'ri tavsif Ushbu reaksiyada molekulyar darajada nima sodir bo'lishi tenglama bilan berilgan:
- CaCO 3 (sol.) + 2H + (oq.) → Ca 2+ (oq.) + CO 2 (g.) + H 2 O (l.) (12)
Bu erda har bir turdagi zarrachaning fizik holati qisqacha qavs ichida ko'rsatilgan ( televizor- qiyin, aq.- gidratlangan ion suvli eritma, G.- gaz, va.- suyuqlik).
Tenglama (12) shuni ko'rsatadiki, qattiq CaCO 3 ikkita gidratlangan H + ionlari bilan reaksiyaga kirishib, Ca 2+, CO 2 va H 2 O musbat ionlarini hosil qiladi. (12) tenglama, boshqa to'liq kimyoviy tenglamalar kabi, molekulyar mexanizm reaktsiyalar va moddalar miqdorini hisoblash uchun unchalik qulay emas, ammo u beradi eng yaxshi tavsif mikroskopik darajada sodir bo'ladi.
Kimyoviy tenglamalarni tuzish bo'yicha bilimlaringizni o'zingiz yechim bilan misol orqali ishlang:
13-darsdan umid qilaman" Kimyoviy tenglamalarni yozish"Siz o'zingiz uchun yangi narsalarni o'rgandingiz. Agar sizda biron bir savol bo'lsa, ularni sharhlarda yozing.
O'qituvchi asosiy bo'lib aktyor Tashkilotda kognitiv faoliyat talabalar doimo ta'lim samaradorligini oshirish yo'llarini izlaydilar. Samarali ta'limni tashkil etish faqat bilim va pedagogik jarayonning turli shakllaridan mohirona foydalanish bilan mumkin.
1. Zamonaviy odam nafaqat bilim va malakalar yig‘indisiga, balki dunyoni yagona, murakkab, doimiy rivojlanib boruvchi butunlik sifatida idrok etish qobiliyatiga ham ega bo‘lishi kerak.
Yuklab oling:
Ko‘rib chiqish:
Kimyo bo'yicha maqola: "Kimyoviy tenglamalarda koeffitsientlarni joylashtirish"
Tuzuvchi: kimyo o`qituvchisi
GBOU 626-son o'rta maktab
Kazutina O.P.
Moskva 2012 yil
“Kimyoviy tenglamalarda koeffitsientlarni joylashtirish”
O‘qituvchi o‘quvchilarning bilish faoliyatini tashkil etishda bosh qahramon bo‘lib, o‘qitish samaradorligini oshirish yo‘llarini doimo izlaydi. Samarali ta'limni tashkil etish faqat bilim va pedagogik jarayonning turli shakllaridan mohirona foydalanish bilan mumkin.
1. Zamonaviy inson nafaqat bilim va ko'nikmalar yig'indisiga, balki dunyoni yagona, murakkab, doimo rivojlanib boradigan bir butun sifatida idrok etish qobiliyatiga ega bo'lishi kerak.
Darsga tayyorgarlik algoritmi
mavzu tanlash, maqsadlarni belgilash;
tarkibni tanlash;
o'quvchilarning sinfda ishlashga ijobiy motivatsion munosabatini rivojlantirish vositalari va usullarini aniqlash;
darsni zarur ko'rgazmali va didaktik materiallar bilan jihozlashning spetsifikatsiyasi;
dars rejasini ishlab chiqish
O'qituvchilar uchun "Kimyoviy tenglamada koeffitsientlarni joylashtirish" kimyo darsiga misol
Maqsad: Savolga javob bering: "Nega kimyoviy tenglamada koeffitsientlarni joylashtirishingiz kerak?"
Vazifalar:
Koeffitsientlarni belgilash zarurati muammosi
Koeffitsientlarni belgilash algoritmi
Koeffitsientlar joylashuvining ma'nosini isbotlash
Darslar davomida:
Zamonaviy talaba, agar u o'qisa, olgan bilimiga va qayta ishlanishiga pragmatizm bilan munosabatda bo'ladi. Shuning uchun taqdim etilgan material sizning boshingizga mantiqiy va qisqacha mos kelishi kerak.
Bunga erishish uchun o'qituvchi doimo e'tibor berishi kerak Nima uchun u yoki bu harakatni sinfda o'rganish kerak. Ya'ni, o'qituvchi tushuntirishi kerak. Va keyin, yaxshi ma'noda, yangi mavzu bo'yicha to'g'ri savollarni kuting.
Moddalar massasining saqlanish qonuni
Mashhur ingliz kimyogari R.Boyl turli metallarni ochiq retortda kuydirib, qizdirishdan oldin va keyin tortgan holda metallar massasi kattalashganini aniqladi. Bu tajribalarga asoslanib, u havoning rolini hisobga olmadi va kimyoviy reaksiyalar natijasida moddalarning massasi o'zgaradi, degan noto'g'ri xulosaga keldi. R. Boylning ta'kidlashicha, qandaydir "olovli materiya" mavjud bo'lib, u metall qizdirilganda metall bilan birlashadi va uning massasini oshiradi.
Mg + O 2 MgO
24 g 40 g
M.V.Lomonosov, R.Boyldan farqli o'laroq, kalsinlangan metallar emas ochiq havoda, va muhrlangan retortlarda va kalsinatsiyadan oldin va keyin ularni torting. U reaktsiyadan oldin va keyin moddalarning massasi o'zgarmasligini va kalsinatsiya paytida havoning bir qismi metallga qo'shilishini isbotladi. (O'sha paytda kislorod hali kashf etilmagan edi.) U bu tajribalar natijalarini qonun shaklida shakllantirdi: “Tabiatda sodir bo'ladigan barcha o'zgarishlar shunday holatlardirki, bir jismdan olingan narsa boshqasiga qo'shiladi”. Hozirgi vaqtda ushbu qonun quyidagi shaklda tuzilgan:
Kimyoviy reaksiyaga kirgan moddalarning massasi hosil bo'lgan moddalarning massasiga teng
Mg + O 2 MgO
24 g 32 g 40 g
Savol: qonun bajarilmaydi (chunki boshlang'ich va oxirgi moddalarning massalari teng emas).
Ushbu muammoni hal qilish koeffitsientlarni joylashtirishdir (molekulalar sonini ko'rsatadigan butun sonlar):
2Mg + O 2 2MgO
48 g 32 g 80 g - reaksiyadan oldin va keyin elementlarning atomlari soni ham teng bo'lganligi sababli oldingi va keyingi massalar tengdir.
Shunday qilib, talabalarga massa koeffitsientlarini tenglashtirish zarurligini isbotlab, siz hatto oldingi mavzulardan ba'zilarisiz ham qila olasiz: valentlik bo'yicha moddalar uchun formulalar tuzish, moddaning massasini, miqdorini hisoblash ... Shuningdek, qonun haqida hikoya. materiya massasining saqlanishini 20 yil o'tgach, A. Lavuazye "qayta kashf qildi", bir tomondan buni aniqlab berdi, lekin M.V.ga umuman e'tibor bermadi. Lomonosov axloq bilan, siz uni tark etishingiz mumkin o'z-o'zini o'rganish masalan, hisobot shaklida.
Shunday qilib, bunday turdagi topshiriqlarni muvaffaqiyatli bajarish uchun siz shartni tushunishingiz kerak: reaktsiyadan oldingi atomlar soni db reaktsiyadan keyingi atomlar soniga teng: keling, birgalikda hal qilaylik:
H 2 S + 3O 2 SO 2 + 2H 2 O (o'ng tomonda kislorodni ikki barobarga oshiramiz. Biz ularni chap tomonda hisoblaymiz)
CH 4 + 2O 2 CO 2 + 2H 2 O
Biz koeffitsientlarni ikkita gazning yonish tenglamalariga joylashtirdik
